Основные теоретические положения
Молекулы разных веществ различаются своими свойствами, из которых наиболее важным и поддающимся количественному определению является масса m. Так как массы атомов и молекул невелики, то для определения их значения пользуются шкалой относительных атомных масс.
Относительной атомной массой химического элемента (Аr)называется величина, равнаяотношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов вприроде) к 1 / 12 массы изотопа углерода – 12 ( ). Таким образом, атомная единица массы (а.е.м.) равна
). Таким образом, атомная единица массы (а.е.м.) равна
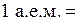
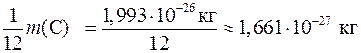 .
.
Относительная атомная масса (или просто атомная масса) является величиной безразмерной. Связь между массой одного атома mа и Аr выражается соотношением
 а.е.м.,кг.
а.е.м.,кг.
Относительной молекулярной массой вещества (Mr)называется отношение массы его молекулы к 1/12 массы атома изотопа углерода  . Численные значения Мr находят как сумму Аr всех элементов, входящих в соединение, например:
. Численные значения Мr находят как сумму Аr всех элементов, входящих в соединение, например:
Мr (Н2S) = 2 · 1,00794 + 1 · 32,06 = 34,0759» 34,08.
В 1971 г. в Международную систему единиц измерения (СИ) была введена единица количества вещества (моль n) – такое количество вещества, которое содержит столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12.
Число атомов, содержащихся в 0,012 кг углерода 12, равно 6,02·1023. Эту величину называют числом Авогадро. Следовательно, в 1 моль любого вещества содержится 6,02·1023 его структурных единиц. Эта константа называется постоянной Авогадро N А (моль-1).
|
|
|
Масса 1 моль вещества называется молярной массой M. Ее можно вычислить как отношение массы вещества m к его количеству n, кг/моль (г/моль):
 ,
, 
Численное значение М (в г/моль) совпадает с Mr вещества или Аr элемента.
Кроме массы при количественных расчетах часто пользуются понятием молярный объем при нормальных условиях (н.у.), V  Это объем, который занимает 1 моль любого газа при н.у., т.е. при давлении101,325 кПа (1 атм или 760 мм рт. ст.) и температуре 273 К (0 °С), V
Это объем, который занимает 1 моль любого газа при н.у., т.е. при давлении101,325 кПа (1 атм или 760 мм рт. ст.) и температуре 273 К (0 °С), V  22,4 дм3/моль.
22,4 дм3/моль.
При количественных расчетах не обязательно записывать уравнение химической реакции и подбирать коэффициенты, если использовать понятия эквивалент и закон эквивалентов.
Эквивалентом Э(Х)называют некую реальную или условную частицу (атом, молекулу, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом равноценна 1 моль атомов водорода или ионов Н+ в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) = 
где z * – число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
|
|
|
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента М Э(Х)(г/моль). Ее можно рассчитать по формуле
М Э(Х) = М (Х) × Э(Х) = 
Число эквивалентности z * для химического элемента, входящего в состав какого-либо вещества, равно модулю степени окисления (С.О.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
М Э(Элемент) = 
Для простого одноатомного вещества (например, Mg, P, S и т.д.) z * равно наиболее характерной валентности В элемента простого вещества. Тогда
М Э(Х) = 
При решении задач с участием газообразных веществ обычно пользуются не М Э , а молярным эквивалентным объемом вещества V Э , т.е. объемом, который занимает 1 моль эквивалентов газа. Расчет V Э газа (в дм3/моль) при н.у. следует вести по формуле
 ,
,
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем газа при н.у., дм3/моль. Например, молярный эквивалентный объем Н2 при н.у. равен

Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы образовавшихся продуктов пропорциональны молярным массам эквивалентов этих веществ.
|
|
|
Дата добавления: 2015-12-18; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
