Электрокинетические явления
Существует ряд электрокинетических явлений, для которых характерно движение раствора относительно заряженной поверхности или наоборот. В электрическом поле наличие заряженной поверхности проявляется в действии на раствор некоторой силы и, наоборот, при движении заряженной поверхности относительно раствора индуцируется электрическое поле.
Классификация различных электрокинетических явлений
| Вид потенциала | Характер относительного движения твёрдой поверхности и дисперсионной среды | |
| Движение дисперсионной среды вдоль неподвижной поверхности (например, стенки или поверхности измерительной ячейки | Движение поверхности относительно неподвижной дисперсионной среды (например, коллоидной частицы) | |
| Наложение | Электроосмос | Электрофорез |
| Генерация потенциала | Потенциал течения | Потенциал седиментации |
По скорости электрофореза, электроосмоса, потенциала течения и седиментации можно рассчитать величину дзета-потенциала.
Электрокинетические явления находят разнообразное техническое применение. Электрофорез используется для нанесения покрытий на различные поверхности, получения чистого каолина из глинистой суспензии - под действием электрического поля частицы каолина осаждаются на одном из электродов. Электрофорез используют также и для обезвоживания нефти, получения активированных катодов для радиоламп, введения различных лекарств в организм. В некоторых случаях для повышения эффективности сушки применяют электроосмос. С помощью его, например, сушат торф, дубят кожу, обезвоживают древесину.
|
|
|


Коагуляция лиофобных дисперсных систем
Для существования дисперсной системы должны соблюдаться следующие условия:
■ постоянство дисперсности;
■ равномерность распределения частиц дисперсной фазы в дисперсионной среде.
Способность дисперсной системы сохранять дисперсность, т.е. размер частиц, во времени называется агрегативной устойчивостью;
способность сохранять равномерность распределения частиц по объему системы - кинетической устойчивостью.
В агрегативно-устойчивых дисперсных системах действуют те или иные факторы стабилизации:
1. Электростатический фактор, обусловленный взаимным отталкиванием заряженных коллоидных частиц при перекрывании диффузных частей ДЭС мицелл.
2. Сольватный фактор, когда молекулы дисперсионной среды сольватируют ионы ДЭС мицеллы, что приводит к лиофилизации поверхности и, следовательно, к снижению межфазной поверхностной энергии. Чем ниже свободная энергия системы, тем выше ее термодинамическая устойчивость. Существование сольватных слоев на межфазных границах приводит к возникновению в узком зазоре между двумя сблизившимися частицами расклинивающего давления - частицы отталкиваются друг от друга и это повышает их агрегативную устойчивость.
|
|
|
3. Структурно-механический фактор, связанный с тем, что на поверхности частиц образуются межфазные адсорбционные слои при добавлении ПАВ и ВМС, обладающие механической прочностью и препятствующие агрегации частиц.
4. Энтропийный фактор, характеризующийся повышением энтропии системы за счет броуновского движения и диффузии, что приводит к выравниванию концентрации дисперсной фазы по всему объему системы.
Нарушение стабилизирующих факторов приводит к потере дисперсной системой устойчивости. Процесс слияния одинаковых по природе и знаку заряда поверхности частиц называется коагуляцией. Коагуляция связана с потерей системой агрегативной устойчивости. Она может быть вызвана действием на систему тепла и холода, столкновением частиц в результате броуновского движения, центрифугирования, действием электрического поля, введением в систему коагулянтов - низкомолекулярных и органических электролитов. Процесс коагуляции присущ лиофобным дисперсным системам, обладающим избытком поверхностной энергии и стремящимся уменьшить её за счёт сокращения удельной поверхности, т.е. числа частиц.
|
|
|
Первый этап коагуляции - это образование агрегатов из нескольких частиц, разделённых прослойками среды (флокуляция). Более глубокий процесс коагуляции приводит к разрушению прослоек среды и непосредственному контакту частиц.
Процесс коагуляции лиофобных золей делится на скрытую и явную стадии. При скрытой коагуляции частицы постепенно теряют свою устойчивость, невооруженным глазом она не обнаруживается. Явная коагуляция характеризуется слипанием и агрегированием частиц под действием молекулярных сил притяжения вплоть до выпадения в осадок. Дисперсность скоагулировавшего золя можно восстановить, добавляя специальные адсорбирующиеся вещества - пептизаторы. Процесс восстановления дисперсности называется пептизацией. При этом повышается заряд частиц дисперсной фазы и происходит их диспергирование за счет электростатического отталкивания. Способность к пептизации характерна для осадков, не хранившихся слишком долго после коагуляции. Наиболее легко пептизируются осадки, образовавшиеся при флокуляции.
|
|
|
Общие правила электролитной коагуляции лиофобных дисперсных систем следующие:
1. Правило знака заряда. Ионом-коагулятором в электролите является только тот ион, который имеет заряд, противоположный знаку заряда коллоидной частицы.
2. Порог коагуляции у, моль/л. Каждый электролит по отношению к данному золю обладает порогом коагуляции, т.е. минимальной концентрацией, достаточной для коагуляции за короткое время:

где сЭ - концентрация электролита-коагулянта; Vэ - объем коагулянта- электролита; V3 - объём золя (коллоидного раствора).
Величина, обратная порогу коагуляции 1/γ - коагулирующая способность электролита.
3. Правило значности (Шульце - Гарди). Коагулирующая способность электролита возрастает с увеличением валентности иона-коагулянта в некоторой высокой степени его заряда (часто 6):
γ = const / z6
где z- валентность иона-коагулянта.
4. Лиотропные ряды. По величине коагулирующей способности ионы одного и того же знака и одной и той же валентности располагают в следующие лиотропные ряды:


Коагулирующая способность органических ионов-коагулянтов во много раз превосходит таковую неорганических ионов. Коагулирующая способность органических ионов одного и того же заряда сильно возрастает с увеличением углеводородного радикала, так как возрастает адсорбционный потенциал.
5. Влияние «ионов-партнёров». Коагулирующая способность данного иона-коагулянга (катиона или аниона) при замене его «партнёра» (аниона или катиона) другим «партнёром» той же валентности, в большинстве случаев меняется незначительно. Например, для коагуляции гидрозоля As2S3 почти безразлично берётся для этого КСl или KNO3, а для гидрозоля Fe(OH ) 3 почти безразлично - КСl или NaCl. Однако из этого правила имеются исключения для органических ионов. Так, коагулирующая способность К+ в отношении гидрозоля As2S3 при переходе от хлорида к ацетату понижается более чем в 2 раза.
6. Связь коагуляции с величиной С-потенциала. Коагуляция связана с уменьшением величины z-потенциала при введении в систему электролитов. То наибольшее значение z-потенциала, при котором начинается явная коагуляция, получило название критического потенциала zкр - потенциала. Независимо от знака, если z-потенциал по абсолютной величине больше zкр -потенциала, то коагуляция не наступает, если же меньше величины zкр - потенциала, то коагуляция идёт с тем большей скоростью, чем меньше потенциал. Величина критического потенциала для лиофобных золей в большинстве случаев одна и та же, а именно 0,03В.
Способность противоиона электролита снижать z-потенциал зависит от его размера, поляризуемости, способности гидратироваться. Чем больше поляризуемость иона, тем больше его способность вызывать коагуляцию, т.е. он быстрее уменьшает толщину ДЭС:
Как видно, способность снижать z-потенциал возрастает от Li+ до Cs+ и от F- до I-.
На рис. показана зависимость величины z-потенциала от радиуса иона-коагулянта.
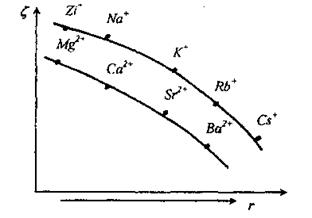
Рис. Зависимость z-потенциала отрицательно заряженных частиц глины от радиуса
Наиболее эффективно на величину z-потенциала действуют индифферентные электролиты. Они не имеют в своём составе ионов, способных достраивать кристаллическую решётку дисперсной фазы. Эти электролиты не изменяют общий скачек потенциала коллоидных частиц, а z-потенциал снижают в результате увеличения концентрации противоионов в системе и сжатия ДЭС (рис.).

Рис. Изменение ветчины z-потенциала в системе при введении индифферентного электролита
Кривая 1 показывает изменение z-потенциала в системе до введения электролита, кривые 2, 3, 4 - после введения электролита. Кривая 4 соответствует изоэлектрическому состоянию системы, когда z-потенциал равен нулю.
Старение золей и пептизация
Термодинамическая неустойчивость лиофобных коллоидных систем является причиной старения золей – самопроизвольной коагуляции (автокоагуляции) золей. Автокоагуляция золей происходит значительно медленнее, чем коагуляция электролитами; так, золи золота могут сохраняться без видимых изменений десятилетиями. Одной из основных причин старения золей является медленно совершающийся процесс перекристаллизации вещества ядра.
Пептизацией (дезагрегацией) называется процесс расщепления коагулировавшего золя (коагулята) на первичные частицы – процесс, противоположный коагуляции. Пептизация возможна лишь тогда, когда структура частиц в коагуляте не изменена по сравнению с первоначальной (т.е. когда еще не произошло полного сращивания частиц и они слабо связаны друг с другом). Различают непосредственную и опосредованную пептизацию.
Непосредственная пептизация происходит в результате добавления к коагуляту электролита, содержащего потенциалопределяющий ион; в результате его специфической адсорбции на поверхности частиц дисперсной фазы их заряд вновь увеличивается, толщина двойного электрического слоя возрастает. Это приводит к тому, что силы отталкивания между частицами начинают преобладать над силами притяжения; происходит деагрегация – распад образовавшегося ранее агрегата из слипшихся частиц.
Опосредованная пептизация вызывается добавлением в систему вещества, химическое взаимодействие которого с поверхностью коагулята приводит к высвобождению потенциалопределяющих ионов. Например, коагулировавший золь гидроксида железа (III) может быть пептизирован добавлением в систему либо какой-либо соли железа (непосредственная пептизация), либо соляной кислоты (опосредованная пептизация).
Молекулярно-кинетические свойства свободнодисперсных систем
Молекулярно-кинетические свойства дисперсных систем связаны с самопроизвольным движением частиц дисперсной фазы в дисперсионной среде. К этим свойствам относятся: броуновское движение, диффузия, осмотическое давление и кинетическая устойчивость.
Особенности молекулярно-кинетических свойств зависят от степени дисперсности частиц и принципиально не отличаются от свойств истинных растворов. Однако проявляются в сотни и тысячи раз слабее, чем у истинных растворов низкомолекулярных веществ ввиду больших количественных различий в размерах частиц.
К свободнодисперсным системам относятся: аэрозоли - дисперсные системы с газообразной дисперсионной средой и взвешенными твердыми или жидкими частицами; суспензии и коллоидные растворы (золи) - системы с твердой дисперсной фазой и жидкой дисперсионной средой; порошки - осаждённые аэрозоли с твердыми частицами; эмульсии - дисперсные системы, образованные двумя взаимно нерастворимыми жидкостями; пены и газовые эмульсии - системы, состоящие из газообразной дисперсной фазы и жидкой дисперсионной среды.
Характерным общим свойством перечисленных выше систем, особенно если они разбавлены, является склонность к оседанию или всплыванию частиц дисперсной фазы. Оседание частиц дисперсной фазы называется седиментацией, а всплывание частиц - обратной седиментацией.
На частицы любой дисперсной системы, с одной стороны, действует сила тяжести, а с другой - они подвержены диффузии, которая стремится выровнять концентрацию частиц во всех точках системы. При наступлении равновесия, частицы дисперсной фазы определенным образом распределены по высоте. Распределение частиц по высоте при достижении равновесия определяет кинетическую устойчивость, т.е. устойчивость частиц дисперсной фазы к действию силы тяжести. За меру кинетической (или седиментационной) устойчивости принимают гипсометрическую высоту А, на которой υ - число частиц в единице объёма (численная концентрация) - становится в е раз меньше исходной численной концентрации υ0.
Распределение частиц по высоте описывает гипсометрический закон Лапласа (от лат. hypsos -высота):

где v - объем, занимаемый одной частицей; к - постоянная Больцмана; r и r0 - плотность дисперсной фазы и дисперсионной среды соответственно.
Седиментационно-устойчивые дисперсные системы - это золи, стабилизированные эмульсии. Они могут сохраняться без осаждения долгое время.
Неустойчивые системы - суспензии, нестабилизированные эмульсии, пыли. Для них характерен процесс седиментации - оседания частиц без слипания под действием силы тяжести.
Седиментация в жидкой среде описывается законом Стокса:

где r - радиус оседающих частиц, м; U - скорость седиментации частиц, м/с; η - вязкость дисперсионной среды, Па×с.
Большинство дисперсных систем являются лиофобными. Для них характерны:
• гетерогенность, наличие четко выраженной межфазной границы;
• высокая степень раздробленности дисперсной фазы;
• процесс диспергирования является несамопроизвольным, требует затраты энергии;
• наличие избытка свободной поверхностной энергии, что обусловливает стремление к коагуляции. Свойства лиофобных систем были подробно рассмотрены в предыдущих главах.
Теперь мы переходим к рассмотрению лиофильных систем, свойства которых принципиально отличаются от свойств лиофобных систем, а именно:
• образование этих систем происходит самопроизвольно, часто с выделением энергии;
• имеет место сильное межмолекулярное взаимодействие между частицами дисперсной фазы и дисперсионной средой. Межфазовое поверхностное натяжение очень мало, а межфазовая граница размыта;
• системы являются термодинамически устойчивыми, что означает постоянство во времени концентрации и размеров частиц.
К лиофильным системам относятся:
• коллоидные поверхностно-активные вещества (ПАВ);
• растворы высокомолекулярных соединений (ВМС).
Дата добавления: 2015-12-18; просмотров: 39; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
