Порядок выполнения работы
Качественные реакции на анионы:
SO  ; CO
; CO  ; PO
; PO  ; Cl-; J-; CH3COO-; NO
; Cl-; J-; CH3COO-; NO  ; OH-; C2О
; OH-; C2О 
Ход работы: к 2-3 каплям раствора, содержащий определяемый ион, прилейте несколько капель реактива на этот ион. Наблюдение запишите.
Реакция на SO  ион
ион
Катион Ва2+ с сульфат – ионом образует мелкокристаллический осадок белого цвета, который нерастворим в HNO3:
Na2SO4 + BaCl2 ® 2NaCl + BaSO4↓
2Na+ + SO  + Ba2+ + 2Cl- ® 2Na+ + 2Cl- + BaSO4↓
+ Ba2+ + 2Cl- ® 2Na+ + 2Cl- + BaSO4↓
SO  + Ba2+ = BaSO4↓
+ Ba2+ = BaSO4↓
BaSO4 + HNO3 = реакция не идет
Реакция на CO  ион
ион
1. Кислоты, в том числе разбавленные, разлагают карбонаты с выделением двуокиси углерода:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O +CO2
2Na+ + СO  + 2H+ + 2NO
+ 2H+ + 2NO  = 2Na+ +2NO
= 2Na+ +2NO  + H2O + CO2
+ H2O + CO2
СO  + 2H+ = H2O + CO2
+ 2H+ = H2O + CO2
2. Ион Ва2+ с ионом СO  образует белый осадок, растворимый в кислотах: (HCl, HNO3):
образует белый осадок, растворимый в кислотах: (HCl, HNO3):
Na2CO3 + BaCl2 = 2NaCl + BaCO3¯
2Na+ + СO  + Ba2+ + 2Cl- = 2Na+ + 2Cl- +BaCO3¯
+ Ba2+ + 2Cl- = 2Na+ + 2Cl- +BaCO3¯
СO  + Ba2+ = BaCO3¯
+ Ba2+ = BaCO3¯
BaCO3 +2HCl = BaCl2 + H2O +CO2
BaCO3 + 2HNO3 = Ba(NO3)2 +H2O +CO2
Реакция на PO  ион
ион
1. Ион Ва2+ осаждает фосфат-ион в виде белого осадка, растворимого в азотной кислоте:
2Na3PO4 + 3BaCl2 = 6NaCl + Ba3 (PO4)2↓
6Na+ + 2PO  + 3Ba2+ + 6Cl- = 6Na+ + 6Cl- + Ba3 (PO4)2↓
+ 3Ba2+ + 6Cl- = 6Na+ + 6Cl- + Ba3 (PO4)2↓
2PO  + 3Ba2+ =Ba3 (PO4)2↓
+ 3Ba2+ =Ba3 (PO4)2↓
Ba3 (PO4)2 + 6HNO3 = 2H3PO4 + 3Ba (NO3)2
2. Магнезиальная смесь (водный раствор соли магния, содержащий NH4Cl и NH4OH), осаждает фосфат-ион в виде кристаллического осадка MgNH4PO4, который легко растворим в кислотах:
Na2HPO4 + NH4OH + NH4Cl + MgCl2 = 2NaCl + H2O + MgNH4PO4↓
HPO  + NH4OH + Mg2+ = MgNH4PO4↓ + H2O
+ NH4OH + Mg2+ = MgNH4PO4↓ + H2O
Реакция на Cl- ион
1. Катион Ag+ с хлорид – ионом образует осадок белого цвета, растворимый в NH4OH:
|
|
|
AgNO3 + KCl = AgCl↓ + KNO3
Ag+ + NO  + K+ + Cl- = K+ + NO
+ K+ + Cl- = K+ + NO  + AgCl¯
+ AgCl¯
Ag+ + Cl- =AgCl¯
AgCl + 2NH4OH = [Ag (NH3)2]Cl + 2H2O
AgCl + 2NH4OH = [Ag (NH3)2]+ + Cl- + 2H2O
Если на полученную комплексную соль подействовать раствором азотной кислоты, то снова выпадает белый творожистый осадок:
[Ag (NH3) 2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
[Ag (NH3)2]+ + Cl- + 2H+ =AgCl¯ + 2NH 
2. Катион Pb2+ с хлорид-ионом образует осадок белого цвета:
Pb (NO3)2 + 2KCl = PbCl2↓ + 2KNO3
Pb2+ + 2NO  + 2K+ + 2Cl- = PbCl2↓ +2K+ + 2NO
+ 2K+ + 2Cl- = PbCl2↓ +2K+ + 2NO 
Pb2+ + 2Cl- = PbCl2↓
Реакция на CH3COO- ион
При нагревании раствора соли, содержащей ацетат-ион, с раствором кислоты, появляется характерный запах уксусной кислоты:
CH3COOK + HNO3 = CH3COOH + KNO3
CH3COO- + H+ = CH3COOH
Реакция на NO  ион
ион
1. При добавлении дифениламина к раствору, содержащему NO  , образуется интенсивно синее окрашивание, которое постепенно изменяет свой цвет до коричневого.
, образуется интенсивно синее окрашивание, которое постепенно изменяет свой цвет до коричневого.
2. J- в кислой среде окисляется ионами NO  с образованием элементарного йода (раствор приобретает желтоватую окраску):
с образованием элементарного йода (раствор приобретает желтоватую окраску):
2KNO3 + 6KJ +4H2SO4 = 4K2SO4 + 3J2 + 4H2O + 2NO
 2 NO
2 NO  + 4H+ + 3 ē = NO + 2H2O
+ 4H+ + 3 ē = NO + 2H2O
3 2J- - 2 ē = J2

2NO  + 8H+ + 6J- = 2NO + 4H2O + 3J2
+ 8H+ + 6J- = 2NO + 4H2O + 3J2
Наличие свободного йода в растворе определяется по синему окрашиванию раствора при приливании 1 – 2 капли крахмала.
|
|
|
Реакция на J- ион
J- - анион йодистоводородной кислоты бесцветен.
1. Катион Pb2+ образует с иодид-ионом осадок желтого цвета:
Pb (NO3)2 + 2KJ = PbJ2↓ + 2KNO3
Pb2+ + 2NO  + 2K+ + 2J- = 2K+ + 2NO
+ 2K+ + 2J- = 2K+ + 2NO  + PbJ2↓
+ PbJ2↓
Pb2+ + 2J- = PbJ2↓
Осадок растворите в 5-6 каплях уксусной кислоты при нагревании. Пробирку осторожно охладить под струей холодной воды, хлорид свинца выпадает из раствора в виде золотистых хлопьев.
2. Перманганат MnO  в кислой среде окисляет J- до J2:
в кислой среде окисляет J- до J2:
10NaJ + 2KMnO4 + 8H2SO4 = 5J2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
 |
2 MnO  + 8H+ +5 ē = Mn2+ + 4H2O
+ 8H+ +5 ē = Mn2+ + 4H2O
5 2J- - 2 ē = J2
 |
2MnO  + 16H+ + 10J- = 2Mn2+ + 8H2O + 5J2
+ 16H+ + 10J- = 2Mn2+ + 8H2O + 5J2
При этом малиновая окраска исчезает и появляется желтовато-коричневая окраска, обусловленная образованием J2, присутствие которого доказывают по реакции с раствором крахмала.
3. Катион Ag+ образует с иодид – ионом осадок желтого цвета, не растворимый в азотной кислоте:
AgNO3 + KJ = AgJ↓ + KNO3
Ag+ + NO  + K+ + J- = AgJ↓ + K+ + NO
+ K+ + J- = AgJ↓ + K+ + NO 
Ag+ + J- = AgJ↓
AgJ + HNO3 = реакция не идет
Реакция на C2O  ион
ион
1. Перманганат ион в кислой среде окисляет оксалат ион до двуокиси углерода:
5H2C2O4 + 2KMnO4 + 8H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8H2O
 5 C2O
5 C2O  - 2 ē = 2CO2
- 2 ē = 2CO2
2 MnO  + 8H+ + 5 ē = Mn2+ +4H2O
+ 8H+ + 5 ē = Mn2+ +4H2O
 |
5C2O  + 2MnO
+ 2MnO  + 16H+ = 10CO2 + 2Mn2+ + 8H2O
+ 16H+ = 10CO2 + 2Mn2+ + 8H2O
|
|
|
реакция идет очень медленно, рекомендуется нагревание.
2. Соли кальция образуют с оксалатами осадок белого цвета:
CaCl2 + (NH4)2C2О4 = CaC2О4↓ + 2NH4Cl
Ca2+ + 2Cl- + 2NH 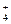 + C2О
+ C2О  = CaC2О4↓ + 2Cl- + 2NH
= CaC2О4↓ + 2Cl- + 2NH 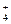
Ca2+ + C2О  = CaC2О4↓
= CaC2О4↓
Реакция на H+ ион и OH- ион
Реакцию среды определяют при помощи индикаторов-веществ, меняющих свой цвет в зависимости от относительной концентрации ионов водорода и ионов гидроксила. Наиболее известным индикатором, используемым для определения Н+ или ОН-, является универсальная индикаторная бумага. К универсальной индикаторной бумаге прилагается цветная шкала, по которой, соотнося цвет индикатора, устанавливают рН раствора.
Дата добавления: 2015-12-17; просмотров: 18; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
