Определение массы газа, находящегося в подземном резервуаре геометрической формы.
Оглавление
1. Введение 2-4
2. Исходные данные 4-6
3. Задача 1 7-8
4. Задача 2 8
5. Задача 3 8-9
6. Задача 4 9-10
7. Задача 5 10-11
8. Задача 6 11-13
9. Задача 7 13-14
10. Задача 8 14-15
11. Задача 9 15
12. Задача 10 16
13. Заключение 17
14.Литература 18
Введение
Россия является неоспоримым лидером по запасам углеводородного сырья! Бережное и по-хозяйски рациональное использование данного нам сырьевого ресурса - наша с вами задача! Углеводороды — это соединения углерода с водородом, не содержащие других элементов. В реальных условиях сложившейся структуры промышленности и сельского хозяйства топливно-энергетический комплекс остается ключевым звеном всей экономической системы государства. Поэтому обеспечение устойчивого и надежного его функционирования является необходимым условием энергетической безопасности как отдельных регионов, так и государства в целом.
Неоспоримую роль для устойчивого и надежного функционирования топливно-энергетического комплекса оказывают хранилища газообразных и жидких углеводородов. Хранилища газообразных и жидких углеводородов являются необходимым элементом функционирования трёх основных составляющих топливно-энергетического комплекса страны: единой системы газоснабжения, системы снабжения нефтепродуктами и системы энерго- и теплоснабжения.
Создание хранилищ газонефтепродуктов проводится на основе новейших достижений науки и техники в этой области с учётом экологической ситуации района размещения хранилищ и соблюдением правил безопасности. В наибольшей степени этим условиям отвечают подземные хранилища, создаваемые в пористых, проницаемых горных породах (для природного газа) и в отложениях каменной соли (для газообразных и жидких углеводородов), которые обеспечивают лучшую защиту окружающей среды от вредного воздействия газонефтепродуктов, имеют высокую пожаровзрывобезопасность и защищённость от воздействия всех видов современного оружия.
|
|
|
Умение прогнозировать поведение веществ в условиях пожара, оценить влияние тех или иных условий, при которых возможно протекание и прекращение горения, возможно на основе химических теорий.
Расчёт некоторых физико-химических свойств, состава углеводородных газов необходим, к примеру, для прогнозирования возможных ситуаций при аварийных режимах (размер зон, ограниченных нижним концентрационным пределом распространения пламени; размеры зон распространения облака горючих газов при аварии и времени достижения облаком мест расположения различных объектов; определение давления в аппаратах при высоких температурах в условиях пожара (нарастание давления, критические температуры) и др).
|
|
|
Все вещества подразделяют на неорганические и органические. Такое деление возникло еще на заре развития химической науки, когда люди установили, что свойства веществ, встречающихся в животных или растительных организмах, значительно отличаются от свойств веществ, полученных из неживой природы. Считалось, что получить искусственным путем органические соединения невозможно. Современная наука утверждает, что нет принципиального различия между неорганическими и органическими веществами. Ученые научились получать искусственным путем такие соединения, которые раньше добывались только из живых растительных или животных организмов. Изменилось само понятие — органическое вещество. В настоящее время принято считать органическими веществами соединения углерода, а науку о соединениях углерода — органической химией. Органические соединения гораздо многочисленнее, чем неорганические. В настоящее время известно около 100 тыс. неорганических и более миллиона органических соединений, причем получены даже такие органические вещества, которых нет в природе.
Простейшими органическими соединениями являются углеводороды. Особенность этих веществ заключается в том, что их молекулы состоят только из атомов двух элементов — водорода и углерода.
|
|
|
Как известно, атомы в молекулах связаны в соответствии с их валентностью. Ковалентная (совместно валентная) связь характеризуется наличием в молекуле вещества общих электронных пар между соединившимися атомами. Атомы углерода способны соединяться друг с другом одной парой общих электронов (простая связь) и двумя или тремя парами (кратная связь). Органические соединения, в молекулах которых имеются только простые связи между атомами углевода, называют насыщенными, или предельными, а имеющие кратные связи ненасыщенными, или непредельными.
Атомы углерода могут соединяться между собой в большом числе и образовывать цепи — открытые, или линейные, и замкнутые в кольца — циклические. Углеводороды могут образовывать ряды, т. е. группы соединений, обладающих сходными химическими свойствами.
Для того чтобы образовать устойчивую внешнюю оболочку, состоящую из 8 электронов, углероду необходимо присоединить 4 электрона. Потеря или присоединение такого большого числа электронов — явление чрезвычайно редкое. Практически таким путем соединения углерода не образуются. Вместо этого атом углерода образует устойчивую систему путем спаривания своих электронов е электронами других атомов, в том числе и с электронами других атомов углерода. Четыре атома одновалентного водорода, соединяясь с одним атомом четырехвалентного углерода, как бы совместно владея своими электронами на внешних оболочках, образуют молекулу простейшего углеводорода метана.
|
|
|
Предельные углеводороды также называются насыщенными, парафиновыми или алканами. Метан является родоначальником ряда предельных углеводородов. Из метана различными методами можно получить все другие углеводороды предельного ряда. Так, например, при действии на метан хлора образуется хлористый метил. Этан — следующий за метаном углеводород предельного ряда. В отличие от метана в молекуле этана по одной валентности каждого атома углерода затрачено на соединение друг с другом. Аналогичным путем могут быть получены и другие углеводороды предельного ряда.
Цель работы: узнать физические и химические свойста метана, этана и циклопропана. Определить их пожаровзрывоопасность и важность в наши дни.
Актуальность исследования и расчетов: неоспоримую роль для устойчивого и надежного функционирования топливно-энергетического комплекса оказывают хранилища газообразных и жидких углеводородов. Хранилища газообразных и жидких углеводородов являются необходимым элементом функционирования трёх основных составляющих топливно-энергетического комплекса страны: единой системы газоснабжения, системы снабжения нефтепродуктами и системы энерго- и теплоснабжения. Создание хранилищ газонефтепродуктов проводится на основе новейших достижений науки и техники в этой области с учётом экологической ситуации района размещения хранилищ и соблюдением правил безопасности. В наибольшей степени этим условиям отвечают подземные хранилища, создаваемые в пористых, проницаемых горных породах (для природного газа) и в отложениях каменной соли (для газообразных и жидких углеводородов), которые обеспечивают лучшую защиту окружающей среды от вредного воздействия газонефтепродуктов, имеют высокую пожаровзрывобезопасность и защищённость от воздействия всех видов современного оружия.
Расчёт некоторых физико-химических свойств, состава углеводородных газов необходим, к примеру, для прогнозирования возможных ситуаций при аварийных режимах (размер зон, ограниченных нижним концентрационным пределом распространения пламени; размеры зон распространения облака горючих газов при аварии и времени достижения облаком мест расположения различных объектов; определение давления в аппаратах при высоких температурах в условиях пожара (нарастание давления, критические температуры) и др.).
Описание веществ:
Этен
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный товар обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этен служит сырьем для получения полиэтилена.
Этен в смеси с кислородом используют в медицине для наркоза.
Этен является фитогормоном у практически всех растений.
В природе этен практически не встречается. Он обладает свойствами фитогормонов - замедляет рост, ускоряет старение клеток, созревание и опадение плодов.
Этен - исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этена, являющихся основой ряда синтетических смазочных масел. Сополимеризацией этена с пропеном на Катализаторах Циглера-Натты получают этен-пропиленовые каучуки, обладающие повышенной устойчивостью к окислению и истиранию. В промышленности получают также сополимеры этена со стиролом и винилацетатом.
Применяют этен в промышленном органическом синтезе (в ряде процессов он вытесняет ацетилен), а также как регулятор роста растений, для ускорения созревания плодов, дефолиации растений и снижения преждевременного опадания плодов.
Газ этен (С2Н4) справедливо относят к гормонам растений, так как он синтезируется в растениях и в крайне низких концентрациях регулирует их рост, активирует созревание плодов, вызывает старение листьев и цветков, опадение листьев и плодов, участвует в ответе растений на различные стрессовые факторы и в регуляции многих других важных событий в жизни растения.
Этен, точнее, этиленпродуценты - соединения, разрушение которых сопровождается выделением этена, имеют широкое применение в практике сельского хозяйства. Все это определяет большое внимание биохимиков, физиологов, генетиков, молекулярных биологов и практиков к изучению этена.
Пропен - СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ. Наркотик с наркотическим действием более сильным, чем у этилена. Класс опасности - четвертый
Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= -47,7 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d204=0,5193.
[править]Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей.
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом).
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Дано:
1- этен C2H4
2- пропен С3Н6
ω(C2H4) =50%
ω(С3Н6) = 50%
l=76 м
g=20 м
h=19 м
Рхр=14 МПа
Рбуф=2.7 МПа
Тхр = 267 К
Задания
Определение массы газа, находящегося в подземном резервуаре геометрической формы.
Найду молярные массы составляющих газовой смеси:
M(C2H4)=12*2+1*4=28 г/моль

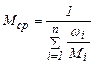 - определяю среднюю молярную массу смеси газов, Мi – молярная масса i-го компонента смеси [г(кг)/моль(кмоль)], ωi – массовая доля газа i-го компонента
- определяю среднюю молярную массу смеси газов, Мi – молярная масса i-го компонента смеси [г(кг)/моль(кмоль)], ωi – массовая доля газа i-го компонента



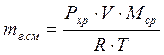 - вычисление массы газовой смеси, где рхр – давление хранения [Па], V[1] – объём газовой смеси (объём резервуара подземного хранилища) [м3], mгаз.см. – общая масса смеси углеводородов [кг], R – универсальная газовая постоянная (8,314 Дж/(моль·К)), Мср – средняя молярная масса газовой смеси [кг/моль], Tхр – температура хранения углеводородов в подземном хранилище.
- вычисление массы газовой смеси, где рхр – давление хранения [Па], V[1] – объём газовой смеси (объём резервуара подземного хранилища) [м3], mгаз.см. – общая масса смеси углеводородов [кг], R – универсальная газовая постоянная (8,314 Дж/(моль·К)), Мср – средняя молярная масса газовой смеси [кг/моль], Tхр – температура хранения углеводородов в подземном хранилище.


Ответ: 6,1· 106 кг - масса смеси находящаяся в подземном резервуаре.
Дата добавления: 2015-12-17; просмотров: 17; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
