V. Van der Waals Forces
75. Peptid bonds, Polypeptides Biologically active peptides.
peptide, organic compound composed of amino acids
linked together chemically by peptide bonds. The peptide bond always involves a single covalent link between the α-carboxyl (oxygen-bearing carbon) of one amino acid and the amino nitrogen of a second amino acid. In the formation of a peptide bond from two amino acids, a molecule of water is eliminated. Small peptides with fewer than about ten constituent amino acids are called oligopeptides, and peptides with more than ten amino acids are termed polypeptides. Compounds with molecular weights of more than 10,000 (50–100 amino acids) are usually termed proteins. Organisms commonly contain appreciable quantities of low-molecular-weight peptides some arising from proteins while others are synthesized directly. Certain of these molecules are unusual in that they incorporate amino acids not found in proteins such as amino acids of the d-configuration. Among the biological peptides are many with physiological or antibacterial activity, such as the peptide hormones oxytocin
and vasopressin; adrenocorticotropic hormone
(ACTH), secreted by the pituitary gland; and several cyclic peptides, in which the amino-acid sequence forms a ring structure rather than a straight chain, such as the antibiotics tyrocidin and gramicidin
. Laboratory synthesis of peptides has risen to the level of a well-defined art in recent years. Synthetic peptides, composed of as many as a hundred amino acids in specified sequence, have been prepared in the laboratory with good purity and high yields.
76. Simple proteins, their characteristics and the main representatives.
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины, глютелины.
До 80-х годов XX века в научной литературе на русском языке простые белки часто обозначались термином «протеины». Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы (эллипсоид вращения), растворимы в воде и в разбавленных солевых растворах. Хорошая растворимость объясняется локализацией на поверхности глобулы заряженных аминокислотных остатков, окруженных гидратной оболочкой, что обеспечивает хороший контакт с растворителем. К этой группе относятся все ферменты и большинство других биологически активных белков, исключая структурные.
|
|
|
Среди глобулярных белков можно выделить:
1. альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2. полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3. гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4. протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
|
|
|
5. проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
6. глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
77. The characteristics of complicated proteins - nucleoproteids. chromaproteids, phosphoproteids, glycoproteids and lipoproteids.
A nucleoprotein is any protein that is structurally associated with nucleic acid[1] (either DNA or RNA).
A chromoprotein is a conjugated protein that contains a pigmented prosthetic group (or cofactor). A common example is hemoglobin, which contains a heme cofactor, which is the iron-containing molecule that makes oxygenated blood appear red. Other examples of chromoproteins are: myoglobin, cytochromes and flavoproteins.
In hemoglobin: chromoprotein (tetramer MW:4 x 16.125 =64.500) Heme: Fe++ four pyrrol rings.
Phosphoproteins are proteins that are physically bonded to a substance containing phosphoric acid.[1][2] This category of organic molecules includes Fc receptors, Ulks, Calcineurins, K chips, and urocortins.
Glycoproteins are proteins that contain oligosaccharide chains (glycans) covalently attached to polypeptide side-chains. The carbohydrate is attached to the protein in a cotranslational or posttranslational modification. This process is known as glycosylation. Secreted extracellular proteins are often glycosylated. In proteins that have segments extending extracellularly, the extracellular segments are also glycosylated. Glycoproteins are often important integral membrane proteins, where they play a role in cell–cell interactions. Glycoproteins are also formed in the cytosol, but their functions and the pathways producing these modifications in this compartment are less well understood
|
|
|
A lipoprotein is a biochemical assembly that contains both proteins and lipids, bound to the proteins, which allow fats to move through the water inside and outside cells. The proteins serve to emulsify the lipid (otherwise called fat) molecules. Many enzymes, transporters, structural proteins,antigens, adhesins, and toxins are lipoproteins. Examples include the plasma lipoprotein particles classified under high-density (HDL) and low-density (LDL) lipoproteins, which enable fats to be carried in the blood stream, the transmembrane proteins of the mitochondrion and thechloroplast, and bacterial lipoproteins.
78 Replaceable and irreplaceable amino acids, their formulas and value.
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н; Для детей незаменимыми также являются аргинин и гистидин.
Non essential amino acids are the following ones: alanine, arginine, asparagine, asparaginic acid, glycine (glycocol), glutamine, glutamic acid, praline, serine, tyrosine, cysteine (cystine), citrulline, gamma-aminobutyric acid, ornithine and taurine. Partially replaceable amino acids are the following ones: arginine and histidine. They differ from other amino acids by the fact that our organism can use them for protein production instead of methionine and phenylalanine reciprocally. There are also amino acids that are not synthesized in our bodies but are required for normal state of our vital functions: these are so-called ‘essential’ amino acids. Essential amino acids are the following ones: valine, leucine, isoleucine, threonine, methionine, phenylalanine, tryptophan and lysine. We must receive them with our food regularly. Protein synthesis goes on in our organism uninterruptedly. If at least one irreplaceable amino acid is absent, our organism stops protein production. Absence or shortage of irreplaceable amino acids leads to cessation of growth, decrease of body weight and metabolism violations.
По способности организма синтезировать из предшественников[править | править исходный текст]
· Незаменимые
Для большинства животных и человека незаменимыми аминокислотами являются:
валин
 , изолейцин
, лейцин,треонин,метионин, лизин, фенилаланин, триптофан,
аргинин,
, изолейцин
, лейцин,треонин,метионин, лизин, фенилаланин, триптофан,
аргинин,
 гистидин.
гистидин.
 · Заменимые
Для большинства животных и человека заменимыми аминокислотами являются:
глицин,
· Заменимые
Для большинства животных и человека заменимыми аминокислотами являются:
глицин,
 аланин,
пролин,
аланин,
пролин,
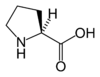 серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
79 Purine and pyrimidine nitrogen bases. Their formulas and value.
серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
79 Purine and pyrimidine nitrogen bases. Their formulas and value.
|
Pyrimidine is an aromatic heterocyclic organic compound similar to pyridine.[2] One of the three diazines (six-membered heterocyclics with twonitrogen atoms in the ring), it has the nitrogens at positions 1 and 3 in the ring.[3] The other diazines are pyrazine (nitrogens 1 and 4) and pyridazine(nitrogens 1 and 2).
|
|
|

A purine is a heterocyclic aromatic organic compound. It consists of a pyrimidine ring fused to an imidazole ring. Purines, including substituted purines and their tautomers, are the most widely occurring nitrogen-containing heterocycle in nature.[1]
Purines and pyrimidines make up the two groups of nitrogenous bases, including the two groups of nucleotide bases. Two of the fourdeoxyribonucleotides and two of the four ribonucleotides, the respective building-blocks of DNA and RNA, are purines.

Дата добавления: 2016-01-04; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
