V ІІ. Виведення молекулярної формули за хімічними властивостями речовин
Приклад №1
Етиленовий вуглеводень, що утворився із 24 г одноатомного насиченого спирту при нагріванні з концентрованою сульфатною кислотою, приєднує 15,3 мл брому (ρ = 3,14 г/см3). Який спирт використали для реакції? Врахуйте, що масова частка виходу алкену становить 75% від теоретичного.
 Дано: Розв’язування:
Дано: Розв’язування:
m(СnH2n+1OH) = 24г 1. Визначаємо масу брому, що приєднує алкен:
V(Br2) = 15,3мл m(Br2) = ρ  V = 15,3 мл
V = 15,3 мл 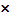 3,14 г/мл = 48 г
3,14 г/мл = 48 г
ρ = 3,14 г/см3 2. Визначаємо кількість речовини брому:
 ωвих. (СnH2n) = 75% υ
ωвих. (СnH2n) = 75% υ 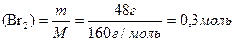
СnH2n+1OH - ?
3. Складаємо рівняння відповідних реакцій:
СnH2n + Br2 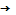 СnH2nBr2
СnH2nBr2
СnH2n+1OH 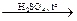 СnH2n + H2O
СnH2n + H2O
4. Визначаємо практичну кількість речовини алкену, що приєднує бром:
υ(Br2) = υпр.(СnH2n) = 0,3 моль
5. Обчислимо теоретичну кількість виходу алкену:
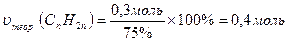
6. Обчислимо молярну масу одноатомного насиченого спирту:
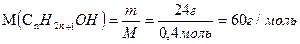
7. Обчислимо число атомів Карбону в сполуці спирту :
12n +2n +1 +17 = 60
14n =42
n=3
8. Виводимо формулу одноатомного насиченого спирту:
С3Н7OH
Відповідь: для реакції використали пропанол (С3Н7OH)
Приклад №2
|
|
|
Для каталітичного гідрування алкіну невідомого складу потрібно використати 1,7 л водню (н.у.). Така ж сама маса вуглеводню під час взаємодії з бромом утворює 15,24 г тетраброміду з розгалуженим карбоновим скелетом. Визначте формулу алкіну.
 Дано: Розв’язування:
Дано: Розв’язування:
V(H2) = 1,7 л 1. Складаємо рівняння відповідних реакцій:
m(СnH2n-2Br4) = 15,24г СnH2n-2 + 2H2 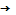 СnH2n+2
СnH2n+2
 СnH2n-2 + 2Br2
СnH2n-2 + 2Br2 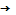 СnH2n-2Br4
СnH2n-2Br4
СnH2n - ? 2. Обчислимо кількість речовини водню
що вступив у реакцію каталітичного
гідрування алкіну :
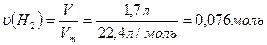
3. Обчислимо кількість речовини брому, що вступив у реакцію:
υ(Br2)= 0,076 моль
4. Обчислимо масу брому:
m(Br2) = М 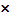 υ = 160 г/моль
υ = 160 г/моль 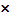 0,076 моль = 12,16 г
0,076 моль = 12,16 г
5. Обчислимо масу алкіну:
m(СnH2n-2) = m(СnH2n-2Br4) – m(Br2) = 15,24 – 12,16 = 3,08 г
6. Обчислюємо кількість речовини алкіну за рівнянням реакції приєднання брому:
υ(СnH2n-2) = υ(Br2)/2 = 0,076/2 = 0,038 моль
7. Обчислюємо молярну масу алкіну:
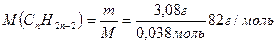
8. Обчислюємо число атомів Карбону в алкіні:
12n + 2n – 2 = 82
|
|
|
14n = 84
n=6
9 . Виводимо формулу алкіну:
С6H10
Відповідь: формула алкіну С6H10 (гексин)
Приклад №3
Внаслідок нагрівання насиченого одноатомного спирту з концентрованою йодидноюкислотою утворилась сполука, в якій масова частка йоду становить 74,7%. Визначте формулу одноатомного спирту.
 Дано: Розв’язування:
Дано: Розв’язування:
СnH2n+1OH СnH2n+1OH + НI → СnH2n+1I + H2O
ω  (I) = 74,7% Mr(СnH2n+1I) = 14n + 128
(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
СnH2n+1OH - ? 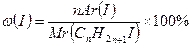
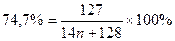
74,7 (14n + 128) = 12700
1045,8n + 9561,6 = 12700
1045,8n = 3138,4
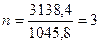 ; С3Н7ОН
; С3Н7ОН
Відповідь: Формула спирту С3Н7ОН (пропанол)
Приклад №4
Маса продукту приєднання гідроген броміду до вуглеводню етиленового ряду виявилась у 2,929 раза більшою за масу вихідного вуглеводню.
Визначте формулу етиленового вуглеводню.
 Дано: Розв’язування:
Дано: Розв’язування:
m(CnH2n) ×2,929 = 1. Складаємо рівняння реакції:
|
|
|

 m(CnH2n+1Br) CnH2n + НBr CnH2n+1Br
m(CnH2n+1Br) CnH2n + НBr CnH2n+1Br
CnH2n - ? 2. Приймаємо m ( CnH 2 n ) за х, згідно умови m ( CnH 2 n +1 Br )=2,929 х
3. Складаємо співвідношення за кількістю речовин реагентів і продуктів реакції:
υ(CnH2n)= υ(CnH2n+1Br)
4. Визначаємо молярні маси реагентів і продуктів реакції:
М(CnH2n)=12n +2n = 14n
M(CnH2n+1Br)=14n+81
5. Визначаємо кількості речовин:
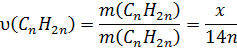
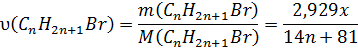
6 . Встановлюємо кількість атомів Карбону у сполуках за пропорцією:
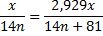
n=3
Отже, у молекулі етиленового вуглеводню 3 атоми Карбону та 6 атомів Гідрогену. Формула вуглеводню C 3 H 6 – пропен.
Відповідь: Формула етиленового вуглеводню C3H6 ( пропен).
Приклад №5
В результаті дії натрію на 13,8г суміші етилового спирту і одноосновної органічної кислоти виділяється 3,36л газу, а в результаті дії на таку ж саму суміш насиченого розчину гідроген карбонату натрію – 1,12л газу. Визначте будову органічної кислоти .
 Дано: Розв’язування:
Дано: Розв’язування:
mсум.(СnH2n+1COOH; 1. Складаємо рівняння реакції взаємодії
C2H5OH) = 13,8 г органічної кислоти та натрій гідроген
V1 заг.(газу) = 3,36 л карбонату:
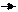 V2 (газу) =1,12 л СnH2n+1COOH + NaHCO3 СnH2n+1COONa+
V2 (газу) =1,12 л СnH2n+1COOH + NaHCO3 СnH2n+1COONa+
 Na, NaHCO3 + H2O + CO2
Na, NaHCO3 + H2O + CO2
СnH2n+1COOH - ? Висновок виділяється вуглекислий газ
|
|
|
ω(СnH2n+1COOH) - ? об’ємом 1,12 л
ω(C2H5OH) - ?
2. Визначаємо кількості речовин вуглекислого газу і органічної
кислоти за рівнянням реакції:
υ(CO2) = υ.(СnH2n+1COOH)
υ(СnH2n+1COOH) = 0,05 моль
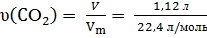 = 0,05 моль
= 0,05 моль
3. При взаємодії натрію як з органічною кислотою так і спиртом виділяється водень:
V1 заг.(Н2) = 3,36л;
4. Складаємо рівняння реакції взаємодії органічної кислоти з натрієм:
 2СnH2n+1COOH + 2Na 2СnH2n+1COONa + H2
2СnH2n+1COOH + 2Na 2СnH2n+1COONa + H2
З попередніх розрахунків υ (С n H 2 n +1 COOH ) складає 0,05 моль, отже υ1(Н2) за рівнянням реакції дорівнює 0,025 моль:
υ2(Н2) = 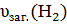 - υ1(Н2) = 0,15моль – 0,025 моль = 0,125 моль
- υ1(Н2) = 0,15моль – 0,025 моль = 0,125 моль
 5. Складаємо рівняння реакції етилового спирту з натрієм:
5. Складаємо рівняння реакції етилового спирту з натрієм:
 2C2H5OH + 2Na 2C2H5ONa + H2
2C2H5OH + 2Na 2C2H5ONa + H2
Відповідно υ(Н2) в даній реакції дорівнює υ2(Н2) = 0,125 моль, а за рівнянням υ( C 2 H 5 OH ) = 0,25 моль
6. Знаходимо маси речовин у суміші:
m(C2H5OH) = M(C2H5OH) × υ(C2H5OH) = 46 г/моль × 0,25 моль =
= 11,5 г
Масу С n H 2 n +1 COOH визначаємо за різницею маси суміші та маси спирту:
m(СnH2n+1COOH) = 13,8 г – 11,5 г = 2,3 г
7. Визначаємо молярну масу органічної кислоти:
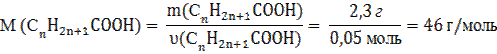
8. Обчислюємо кількість атомів Карбону в органічній кислоті:
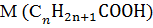 = 12n+2n +46 = 46
= 12n+2n +46 = 46
Висновок: вуглеводневий радикал у формулі даної органічної кислоти замінено містить тільки один атом Гідрогену. Отже, формула органічної кислоти НСООН
Відповідь: Формула одноосновної органічної кислоти НСООН (метанова або мурашина кислота)
Приклад №6
При кількісній міжмолекулярній дегідратації суміші двох одноатомних насичених спиртів невідомої будови виділилось 13,4 г води й утворилось 66г суміші трьох органічних речовин з однаковими кількостями речовин. Відомо, що речовини належать до одного й того ж класу органічних сполук. Визначте склад вихідних спиртів.
 Дано: Розв’язування:
Дано: Розв’язування:
mсум.(3 етерів) = 66г 1) Складаємо рівняння реакції дегідратації суміші 2-х одноатомних
 m(H2O) = 13,5г спиртів:
m(H2O) = 13,5г спиртів:
 Склад вихідних R-OH + R´ - OH R-O-R´ + H2O
Склад вихідних R-OH + R´ - OH R-O-R´ + H2O
спиртів - ? 2) Знаходимо кількість речовини Н2О:
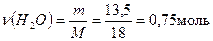
За рівнянням υ (Н2О) = υ( R - O - R´)
υ(R-O-R´) = 0,75 моль
3) Визначаємо молярну масу суміші вуглеводневих радикалів, що входять до складу етерів:
M(R-O-R´) 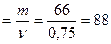 г/моль
г/моль
M(R;R´) =M(R-O-R´) – M(O) = 88 – 16 = 72 г/моль
4) Виводимо вираз для визначення сумарної кількості атомів Карбону у продуктах реакції:
R = CnH2n+1
M(CnH2n+1) = 72 г/моль
12n + 2n = 72
14n = 72
n = 5
Отже, загальна кількість атомів Карбону у суміші вихідних спиртів 5.
Відповідь:
 1 суміш С2Н5ОН – етанол
1 суміш С2Н5ОН – етанол
С3Н7ОН – пентанол
 2 суміш СН3ОН - метанол
2 суміш СН3ОН - метанол
С4Н9ОН – бутанол
 3 суміш СН3ОН - метанол
3 суміш СН3ОН - метанол
С4Н9ОН – ізобутанол
Дата добавления: 2022-11-11; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
