КЛАССИФИКАЦИЯ АДСОРБЦИОННЫХ ПРОЦЕССОВ
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия.
Если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция ↔ Десорбция.
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
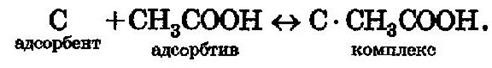
При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных — неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8-40 кДж/моль, т. е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается, так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
|
|
|
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями.
Например, адсорбция кислорода на угле:
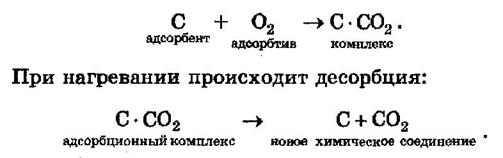
2. Специфичность. Адсорбция происходит, только если возможна химическая реакция.
3. Высокая теплота адсорбции, которая может достигать 800-1000 кДж/моль, т. е. сопоставима с тепловыми эффектами химических реакций.
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
В дальнейшем будем рассматривать только физическую адсорбцию (рис.2.2)
ЗАКЛЮЧЕНИЕ
Особенностью дисперсных систем является наличие большой межфазной поверхности. Молекулы, находящиеся на поверхности раздела фаз, вследствие нескомпенсированности действующих на них сил, обладают повышенной энергией. Мерой поверхностной энергии является поверхностное натяжение (s), равное термодинамически обратимой изотермической работе, которую необходимо затратить для увеличения площади межфазной поверхности на единицу. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше поверхностное натяжение.
|
|
|
Любые процессы протекают самопроизвольно, если они сопровождаются уменьшением свободной энергии. Уменьшение свободной поверхностной энергии возможно либо за счет уменьшения величины межфазной поверхности, либо за счет уменьшения поверхностного натяжения. Стремление частиц принять сферическую форму, процессы коагуляции и коалесценции характерны для индивидуальных веществ, поверхностное натяжение которых постоянно. В тех случаях, когда постоянна площадь межфазной поверхности, самопроизвольно происходят процессы адсорбции — накопления в поверхностном слое частиц, понижающих поверхностное натяжение. Различные виды адсорбции будут рассмотрены в следующих лекциях.
Дата добавления: 2022-07-02; просмотров: 73; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
