ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ТЕМПЕРАТУРЫ
Лекция 2
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
Дисперсные частицы и дисперсионная среда относятся к различным фазам. Система может существовать из разных фаз только в том случае, если межмолекулярные взаимодействия в граничных фазах различны. Единственной системой, в которой межмолекулярные взаимодействия отсутствуют, является идеальный газ. Интенсивность молекулярных взаимодействий возрастает при переходе от реальных газов к твердым телам.
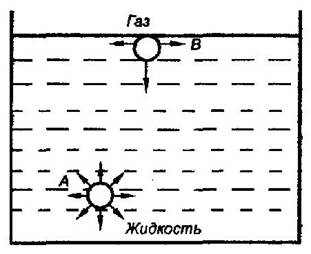
Рис. 2.1 Схема возникновения поверхностной энергии
Рассмотрим систему, состоящую из жидкости (фаза 1) и газа (фаза 2). Силы межмолекулярного взаимодействия в жидкости F1-1 больше сил взаимодействия между молекулами газа F2-2. Возникает вопрос: какие межмолекулярные взаимодействия реализуются на межфазной поверхности? Молекула А (рис 2.1) внутри жидкости окружена со всех сторон другими молекулами. Силы взаимодействия при этом взаимно уравновешиваются. На молекулу В, находящуюся на межфазной поверхности, с одной стороны действуют молекулы жидкости, а с другой — молекулы газа. Поскольку F1-1 > F2-2 возникает результирующая сила Р, направленная в глубь жидкости. Эту силу часто называют внутренним давлением.
Р = F1-1 - F2-2
Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды Р — 14 800 атм. Внутреннее давление Р стремится втянуть молекулу в глубь фазы 1.
|
|
|
Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого надо совершить работу против внутреннего давления, очевидно, чем оно больше, тем больше энергии требуется затратить. Эта энергия сосредоточивается в молекулах, находящихся на поверхности, и называется поверхностной энергией.
Таким образом:
Молекулы тонкого поверхностного слоя (толщиной в одну-две молекулы), разграничивающего две соприкасающиеся фазы, находятся в особом энергетическом состоянии. Оно обусловлено различием сил, действующих на молекулы поверхностного слоя со стороны соприкасающихся фаз. Внутри фазы силы межмолекулярного взаимодействия уравновешивают друг друга, а молекулы поверхностного слоя, по сравнению с молекулами, находящимися в объеме фазы, обладают избыточной энергией, которая называется поверхностной энергиейи обозначается Епов.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
В физике для обозначения понятия об удельной поверхностной энергии на границе раздела фаз газ - жидкость был введен однозначный термин "поверхностное натяжение" - сила, действующая на гипотетическую пленку на поверхности жидкости (аналогичную эластичной пленке) по касательной к этой поверхности, препятствующая ее растяжению и отнесенная к единице длины пленки.
|
|
|
Обозначается поверхностное натяжение также буквой σ в СИ имеет единицу ньютон на метр. Численно обе величины - удельная поверхностная энергия и поверхностное натяжение, выраженные в одной и той же системе единиц, равны: σ [Дж/м2] = σ [Н/м].
Поверхностное натяжение (σ) равно термодинамически обратимой изотермической работе, которую нужно совершить, чтобы увеличить площадь межфазной поверхности на единицу.
В дифференциальной форме поверхностная энергия dE = σ∙ d ∙ Sn ов. , где σ - удельная поверхностная энергия; Sn ов - площадь поверхности раздела соприкасающихся фаз.
Таким образом, поверхностное натяжение — это удельная свободная поверхностная энергия, т. е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше s.
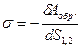
где δАобр. – термодинамически обратимая работа, которую затраченная на образование поверхности площадью dS 1,2 , так как работа совершается над системой, то она является отрицательной.
|
|
|
Обычно работу совершают или при условии постоянства объема и температуры (V,T = const), или при постоянных температуре и давлении (P,T = const). Рассмотрим оба варианта:
1. V,T = const
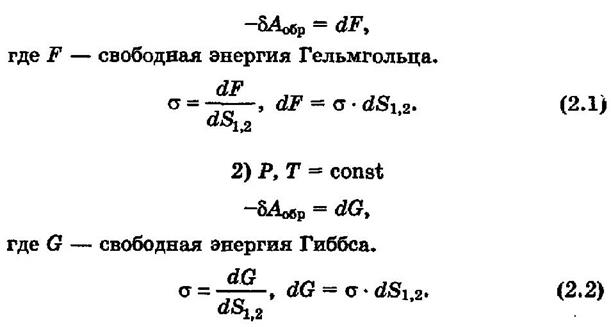
Из приведенного следует, что удельная поверхностная энергия
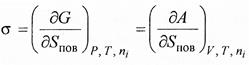
является мерой возрастания энергии Гиббса или Гельмгольца с увеличением площади поверхности раздела фаз Sn ов. при постоянстве соответствующих этим функциям параметров состояния.
Для энергетической оценки всех поверхностных явлений удобнее использовать энергию Гельмгольца, так как некоторые явления (например, капиллярные) протекают с изменением давления в фазах при постоянстве объема системы.
Свободная энергия — это энергия, за счет которой Можно произвести работу.
Таким образом, поверхностное натяжение — это удельная свободная поверхностная энергия, т. е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше σ. Для границы «конденсированная фаза (твердая или жидкая) - воздух» можно пренебречь межмолекулярными взаимодействиями в воздухе (F газ-газ ≈ 0) и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе. В таблице 2.1. приведены значения о некоторых веществ на границе с воздухом.
|
|
|

ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ТЕМПЕРАТУРЫ
Удельная поверхностная энергия (или поверхностное натяжение) на границе неассоциированной жидкости с воздухом или собственным паром с увеличением температуры уменьшается. При температурах, далеких от критической (т.е. Т << Ткр.), зависимость σ = f ( T ) является линейной и подчиняется уравнению
σ2 = σ1 - γ(T2 - T1), (2.3)
где γ = (- dσ / dT) = const — температурный коэффициент поверхностного натяжения, практически не зависящий от температуры T; σ1 и σ2 -поверхностное натяжение соответственно при температуре Т1 и Т2.
Для определения температурной зависимости поверхностного натяжения (удельной поверхностной энергии) можно воспользоваться также уравнением Этвеша
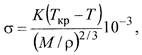
где σ - поверхностное натяжение, Н/м или Дж/м2, при температуре T; К- коэффициент Этвёша, мало зависящий от природы жидкости и температуры; М- молекулярная масса жидкости, г/моль; р - плотность жидкости при температуре Т, г/см3; Ткр. - критическая температура, при которой исчезают различия между жидкостью и паром и выше которой пар не может быть сконденсирован ни при каких давлениях.
Дата добавления: 2022-07-02; просмотров: 95; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
