Сколько электронов у атома бора?
В каком периоде и в какой группе находится бор?
Сколько протонов и нейтронов в ядре атома бора?
Следующий электрон может придти как в гости к уже сидящему на р-орбители, так и на свободную соседнюю: их энергия одинаковая (такие орбитали называются вырожденными). Различие только в том, что в гости он может придти только со спином, противоположным «хозяину», а на соседнюю — с любым. Природа велела электронам на вырожденных орбиталях располагаться так, чтобы суммарный спин был максимальным. Это правило Клечковского. Значит, по этому правилу, следующий электрон займет соседнюю обиталь, вот так:


 Как запишется электронная конфигурация атома углерода? В какой группе он находится?
Как запишется электронная конфигурация атома углерода? В какой группе он находится?
Дальше мы не будем рисовать полную картину расположения электронов, ограничимся только внешним уровнем. Прибавляем еще один электрон. Ну и в ядро не забываем внести соответствующие коррективы. Получаем азот. Этот электрон займет последнюю свободную орбиталь:







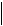









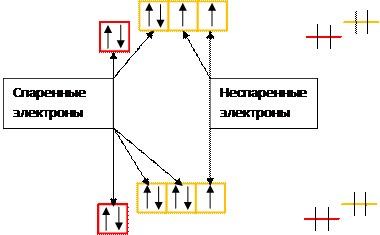
 А дальше, как ни крути, придется электроны спаривать: свободные орбитали кончились, следующий электрон может придти только в гости. Если на одной орбитали сидят два электрона, их принято называть спаренными, а если один — неспаренным. Нарисуем кислород, фтор и неон.
А дальше, как ни крути, придется электроны спаривать: свободные орбитали кончились, следующий электрон может придти только в гости. Если на одной орбитали сидят два электрона, их принято называть спаренными, а если один — неспаренным. Нарисуем кислород, фтор и неон.
 | |||||||||||||||||
 |  | ||||||||||||||||
 |  | ||||||||||||||||
 | |||||||||||||||||
 |  |  | |||||||||||||||
 | |||||||||||||||||
|
|
|
Итак, мы заполнили второй энергетический уровень электронами. Больше сюда не влезет. Такой уровень называется завершенным. А значит, мы закончили и второй период. Следующий элемент Na откроет третий период. И его конфигурация начнется с 1 s2 2 s2 2 p6 3 s1. Или сокращенно: [ Ne] 3 s1. Синим цветом выделена электронная конфигурация неона. Чтобы каждый раз не писать ее, мы просто напишем неон в квадратных скобках, а потом припишем те электроны, которыми наш атом отличается от неона. Если посмотреть внимательно, электронные конфигурации внешнего уровня элементов 3 периода будут повторять конфигурации расположенных над ними элементов 2 периода. Именно поэтому таблица Менделеева называется периодической, именно поэтому мы говорим «периодический закон». «Период» означает «повторяемость».
| I | II | III | IV | V | VI | VII | VIII | ||
| 2 | [He]+ | 2s1 | 2s2 | 2s2 2p1 | 2s2 2p2 | 2s2 2p3 | 2s2 2p4 | 2s2 2p5 | 2s2 2p6 |
| 3 | [Ne]+ | 3s1 | 3s2 | 3s2 3p1 | 3s2 3p2 | 3s2 3p3 | 3s2 3p4 | 3s2 3p5 | 3s2 3p6 |
Из таблицы видно, что конфигурация внешнего уровня повторяется. Чтобы записать сокращенную электронную конфигурацию атома данного элемента, нужно написать сначала в квадратных скобках инертный элемент (так называются элементы VIII группы) предыдущего периода, а затем конфигурацию внешнего уровня. Только не надо таблицу зубрить! Кстати, обращу внимание, что сумма верхних индексов равна количеству электронов на внешнем уровне, а значит и номеру группы. Это можно использовать для проверки. Наконец последнее, на что хочу обратить внимание, это то, что состояние, когда на внешнем уровне сидят 8 электронов (для элементов 1 периода – 2), очень соблазнительно. Если выразиться по-научному — энергетически выгодно. Поэтому благородные элементы, они же инертные, они же элементы VIII группы, чувствуют себя максимально комфортно. А остальные ищут всякие ухищрения, чтобы или нарыть недостающие электроны или скинуть лишние. Чем левее элемент в таблице Менделеева, тем активнее он скидывает электроны, а чем он правее — тем активнее хапает. И может даже с силой у кого-то оторвать. Чем элемент выше, тем лучше берет электроны, чем ниже – тем лучше отдает. Таким образом, самый злобный элемент, готовый нагло утащить электрон себе в норку — фтор. А самый большой любитель спихнуть его другому — франций. Говорят, что фтор — самый электроотрицательный элемент, а франций — электроположительный. Электроотрицательность — это способность элемента притягивать к себе электроны, как свои, так и чужие. Именно эта тяга заполнить или опустошить внешний уровень является причиной образования химический связей, которыми атом привязывает к себе другие атомы.
Дата добавления: 2022-06-11; просмотров: 86; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
