Какой заряд ядра у атома бора?
Немного о строении атома
Атом представляет собой частицу, состоящую из ядра, несущего положительный заряд, и электронов, несущих отрицательные заряды. Сам атом электрически нейтрален. Чтобы понять, как связаны свойства атома, не надо лезть в ядро: все его химические свойства определяются количеством электронов и их расположением. Про ядро нужно знать следующее: оно состоит из положительно заряженных протонов и незаряженных нейтронов. Заряд протона принято считать единицей. Поэтому его так и пишут: p+. Или Н+. А электрон имеет такой же отрицательный заряд: е–. Если мы возьмем один протон и пустим вокруг него крутиться один электрон, мы получим самый простой атом: атом водорода. Можно для интереса к протону подсоединить 1 или 2 нейтрона. Тогда мы получим атомы водорода, но уже с другой массой и другим строением ядра. Но пока ядро несет заряд +1, это будет атом водорода, а не какой-то другой. Атомы, ядра которых различаются только количеством нейтронов, называются изотопами. Таким образом, мы получим 3 изотопа водорода. Водород – это единственный элемент, у изотопов которого есть свои названия: протий – ядро состоит из одного протона, пишется Н; дейтерий, его ядро состоит из 1 протона и 1 нейтрона, пишется D; тритий – ядро состоит из 1 протона и 2 нейтронов, пишется Т. В природе есть источник дейтерия — это тяжелая вода. Обычная вода, в которой вместо обычного водорода сидит дейтерий. Ее еще называют дейтерированной водой. Пишется D2O. В обычной воде содержится около 1–3% тяжелой воды. Ее можно отделить замораживанием: она замерзает при +3°. Также есть сверхтяжелая вода: T2O. Ее в природе еще меньше. Протон и нейтрон имеют примерно одинаковую массу, приблизительно 1 а.е.м. Можно написать, что протий весит 1 а.е.м., дейтерий – 2, а тритий – 3. А масса электрона намного меньше, она в ~1800 раз меньше массы протона или нейтрона. Поэтому, когда считают массу атома, массой электронов пренебрегают. Теперь возьмем 2 протона и приклеим их друг к другу. Тогда мы получим атом другого элемента, потому что заряд ядра будет уже не +1, как у водорода, а +2. И чтобы этот заряд компенсировать, нужно запустить вокруг него 2 электрона. По каким-то причинам, чтобы такое ядро не развалилось, природа запихнула в ядро еще 2 нейтрона. Примерно от гелия до фтора количества протонов и нейтронов в ядре равны, могут отличаться на 1. А дальше количество нейтронов начинает расти. Возьмем атом кислорода. В нем 8 протонов, 8 нейтронов и 8 электронов. Теперь возьмем элемент потяжелее, висмут, например. В нем 83 протона, а нейтронов у него 125! Думаю, сколько у него электронов – писать не надо, и так ясно. Про ядро все. Покажем только, как оно пишется:
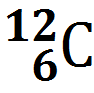
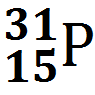
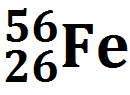
Что означают эти числа? Нижнее число — это заряд ядра Z. Оно так и называется — зарядовое число. А верхнее — масса ядра M. Массовое число. В школе на уроках химии его пишут Ar. По сути это одно и то же. Зарядовое число заодно является и порядковым номером элемента. Количество протонов и электронов равно Z. А нейтронов — М– Z.
Упражнение : пользуясь таблицей Менделеева, посчитать количество протонов, нейтронов и электронов у атомов: F , Si , Cl , Cu , Ag , Hg , Os , Pb , Sn , Pd , Nd , Pu , Es , Md .
Теперь перейдем к электронам. Такие мелкие и шустрые частички, которые нагло командуют свойствами атома. Более того, нельзя выйти с сачком и пытаться его поймать. Можно только теоретически рассчитать вероятность, где его носит. И то пространство, где вероятность его встретить, максимальна, назвали электронным облаком или орбиталью. А ему на нашу вероятность глубоко плевать. Он живет своей жизнью. Но таким явлениями природы, как электрический ток, магнитное поле, свет, а также веществам, которые состоят не из одиночных атомов, а соединенных в молекулы. Мы обязаны именно ему. И свойства атома зависят от энергии, которую в себе несет электрон. Насколько велика или мала его энергия, нам знать неважно. Важно — как она меняется, когда мы даем атому пинка, и его электроны переходят из одного состояния в другое. Представим книжный шкаф. На нем есть полки. Пусть они будут высокими, для простоты. Первая полка находится в 1 метре над землей, обозначим ее буквой К. Вторая — в 2 метрах, обозначим ее буквой L. Третья – в трех, обозначим буквой M. И так далее. Стоит отметить, что буквенные обозначения «полок», на которых носятся электроны — общепринятые. Они часто встречаются в литературе. Мы можем поставить книгу на высоту 1м. Для этого достаточно поставить ее на 1-ую полку. Можем поставить на 2м — для этого мы поставим ее на 2-ую полку. Точно так же на 3. На 5, на 10м… А на 1.5м — не можем поставить. Потому что она упадет на 1 полку. Так и электрон. Физики говорят, что высота книги квантована. И чтобы изменить высоту книги, надо дать ей квант энергии в 1м — чтобы хватило до следующей полки. Точно так же ведет себя и электрон: его энергия квантована. И те значения энергии, которые он умеет принимать, называются энергетическими уровнями или энергетическими оболочками. Т.е. электрон, сидящий на данной оболочке, имеет определенную энергию. Теперь немного информации для общего развития: чтобы перегнать электрон с одной оболочки на другую, более высокую, надо на него посветить. А если он спрыгнет с верхней оболочки на нижнюю, то он будет излучать свет. Собственно, так свет в лампочке и берется. Причем цвет того самого света зависит от расстояния между оболочками: маленькому расстоянию соответствует красный, большому — фиолетовый. Как цвета радуги.
| | | |
| |  |
| |
|
| |
|
| |
|
| |
|
| |
|
Можно объяснить и в цифрах. Пусть энергия К-оболочки 0 Дж, L-оболочки – 30 Дж, а М-оболочки – 100 Дж. На К-оболочке сидит электрон. Если мы дадим ему 20 Дж, он их не возьмет. Ну или возьмет, куда-нибудь подпрыгнет и выплюнет обратно. Во всяком случае, со своего этажа не улетит. Дадим ему 29 Дж. Все равно не возьмет! И неважно, что до следующего этажа ему не хватает всего 1 Джоуля! Дадим 30 Дж. Он подпрыгнет и осядет на L-оболочке. И там останется. Но если он увидит, что на К-оболочке пусто, он может захотеть спрыгнуть вниз, выплюнув эти самые 30 Дж обратно. Теперь дадим ему 35 Дж. Он запрыгнет на L-оболочку. А 5 Дж выплюнет обратно. И будет плеваться, пока мы не дадим ему 100 Дж! А если мы хотим переселить электрон с L-оболочки на М, ему надо дать 70 Дж. Если дадим меньше – он сползет обратно. А если дадим больше – запрыгнет, а все излишки выплюнет назад. Вот такой он капризный. Джоуль — довольно большая единица энергии, ее много для измерения энергии уровней. Поэтому там используют свои единицы — электрон-вольты, эВ. Это те же самые джоули, только маленькие.

Теперь хочется заселить эти оболочки электронами. То количества оболочек, на которых сидят электроны, равно номеру периода, в котором сидит наш элемент. Но мы не выяснили еще одну вещь: сколько электронов можно посадить на каждый уровень? Тут природа оторвалась как могла. Оказывается, вместимость разных уровней различна. Представим теперь, что на книжных полках есть ячейки для книг. Причем эти ячейки стоят не рядом, а немного различаются по высоте. На самом нижнем уровне такая ячейка одна. Ее обозначили буквой
s. Почему? Да потому что орбиталь, в которой летает электрон с такой энергией, похожа на сферу! Так и запишем:
1 s. Цифра 1 означает, что наша орбиталь сидит на 1 этаже. Теперь поднимемся на 1 уровень выше. Там, как выяснилось, есть такая же орбиталь, как и на 1 этаже. Такая же ячейка. Но рядом, на небольшой ступеньке выше сидят еще 3 других, одинаковых между собой ячейки! И им соответствуют 3 новых орбитали! Как они выглядят — покажу позже. Их обозначают буквой
р. Итого природа на 2 этаж ниспослала 1+3=4 орбитали. Напишем:
2 s – 1 шт,
2р – 3 шт. Поднимемся на 3 этаж. Там мы встретим 1
s – орбиталь, 3
р-орбитали и 5
d-орбиталей! Причем эти d-орбитали иногда поднимаются так высоко, что проламывают потолок и оказываются выше 4 этажа! Но эти случаи мы рассматривать не будем. И так далее, с каждым уровнем будет появляться нечетное число новых орбиталей. Теперь нарисуем схему, как оно выглядит. Эти ячейки можно рисовать квадратиками (слева), а можно просто горизонтальными черточками (справа). Это одно и то же.
Вот такие домики для электронов приготовила природа. Теперь осталось выяснить, а сколько электронов поместятся в один «домик»? Электроны, помимо того, что они носятся, как угорелые, по своим орбиталям, которые вживую никто не видел, они еще и вертятся вокруг себя, как планеты. Можно представить, что солнечная система – это атом, в котором Солнце — ядро, а планеты — электроны. Ученые так и говорят: «планетарная модель атома». Так вот, в одном домике уживутся два электрона, при условии, что один крутится вокруг своей оси в одну сторону, а другой – в другую. Вращение частицы вокруг себя называется спин. Если два электрона крутятся в разные стороны, говорят, что у них разные спины, при этом у одного +1/2, а у другого – -1/2. Спин есть и у ядра – он складывается из спинов протонов и нейтронов. Причем у каких-то ядер он равен нулю, а у каких-то нет. И эти частицы ведут себя по-разному в магнитном поле. Эти свойства применяются в физике и в медицине, например, ядерный магнитный резонанс (ЯМР) и магнитно-резонансная томография (МРТ). Если мы пронумеруем все энергетические уровни, на каждом уровне – ячейки, да еще добавим номер каждому спину, то у нас у каждого «домика» появится свой адрес в виде набора чисел. Их называют квантовыми числами. Подробно их можно изучить в книге Хомченко, но в школе достаточно просто знать, что они есть. И куда бы мы ни ткнулись, мы увидим, что нет двух домиков с одинаковыми адресами. И даже если в одном домике сидят два электрона. То у них спины будут разные. Это правило называется принципом Паули. Или, более правильно – принцип запрета Паули. Звучит он так: «не бывает у одного атома двух или более электронов с одинаковым набором квантовых чисел». Вот теперь у нас все готово к заселению. И первый электрон уже на старте. Мы ему даем волшебного пинка, он подлетает выше всех орбиталей и начинает сползать вниз, выплевывая порциями Джоули. Причем каждый раз, останавливаясь в каком-нибудь «домике», он смотрит вниз: нет ли там свободного домика? И если есть, то он выплевывает еще порцию Джоулей и переползает туда. Этот прием называется правилом Хунда. В принципе. Имена знать не обязательно. Важно понимать, как оно работает. Любой электрон стремится занять максимально низкий свободный домик, чтобы его энергия была минимальной. Если домик ниже него свободен, он переходит туда. Если занят, — дальше не идет. Принцип Паули не позволяет.

 И вот наш первый электрон скачет все ниже и ниже и допрыгивает до 1 уровня. Да, до того самого, который обозначается буквой К. И оседает там. На единственной s-орбитали, ибо другой нет. Напишем его домашний адрес: 1 s1. Что означает эта запись? На 1 уровне (большая цифра слева) есть s-орбиталь, на которой сидит 1 электрон (верхний индекс справа)! Вот такой простой адрес! Поскольку он сидит на s-орбитали, так его и назовем: s-электрон. Есть химический элемент, у которого всего 1 электрон. Это водород. Говорят, что это его электронная конфигурация. Ее можно нарисовать. Например, вот так:
И вот наш первый электрон скачет все ниже и ниже и допрыгивает до 1 уровня. Да, до того самого, который обозначается буквой К. И оседает там. На единственной s-орбитали, ибо другой нет. Напишем его домашний адрес: 1 s1. Что означает эта запись? На 1 уровне (большая цифра слева) есть s-орбиталь, на которой сидит 1 электрон (верхний индекс справа)! Вот такой простой адрес! Поскольку он сидит на s-орбитали, так его и назовем: s-электрон. Есть химический элемент, у которого всего 1 электрон. Это водород. Говорят, что это его электронная конфигурация. Ее можно нарисовать. Например, вот так:

Я специально на рисунке выше раскрасил орбитали именно такими цветами: в большей части таблиц Менделеева (в современных учебниках химии раскраска по другому принципу) s, p, d и f-элементы раскрашиваются такими цветами. Последние рисуются зеленым цветом.




 Теперь рассмотрим электронную конфигурацию гелия. Заряд его ядра — +2, а значит, ему природой полагается 2 электрона. Кидаем второй электрон. Он может найти себе место на 1 уровне? Может. Только крутиться вокруг своей оси ему придется в сторону, противоположную соседу. И для того, чтобы на задерживаться на 2 уровне, он повернет свой спин куда надо. Теперь у нас на единственной 1s-орбитали живут два электрона. Как запишется такая электронная конфигурация? 1 s2. Теперь нарисуем ее, сначала квадратиками, а потом черточками:
Теперь рассмотрим электронную конфигурацию гелия. Заряд его ядра — +2, а значит, ему природой полагается 2 электрона. Кидаем второй электрон. Он может найти себе место на 1 уровне? Может. Только крутиться вокруг своей оси ему придется в сторону, противоположную соседу. И для того, чтобы на задерживаться на 2 уровне, он повернет свой спин куда надо. Теперь у нас на единственной 1s-орбитали живут два электрона. Как запишется такая электронная конфигурация? 1 s2. Теперь нарисуем ее, сначала квадратиками, а потом черточками:
Очевидно, что если на одной орбитали сидят 2 электрона, то спин у них разный, поэтому на правой схеме стрелки не рисуются. Рисуются только штрихи. А в квадратиках нарисуем, чтобы не забывать.
Все, на 1 уровень больше электроны не поместятся. А значит, закончился и первый период в таблице Менделеева. В этом периоде всего два элемента: водород и гелий. Вот такой маленький период. Следующий электрон пойдет уже на второй энергетический уровень, и его адрес будет 2 s1. У него уже есть выбор: он может сесть на s, а может и на р-орбиталь. Но поскольку он любит сидеть пониже, а самая нижняя орбиталь — s, то он придет как раз на нее. А полная электронная конфигурация будет записываться так: 1 s2 2 s1. Расшифровать ее можно так: на 1 уровне на s-орбитали сидят 2 электрона, на 2 уровне на s-орбитали сидит 1 электрон. А можно написать сокращенно: [ He] 2 s1. Что это значит? Дело в том, что гелий завершает 1 период. И у нашего элемента электронная конфигурация такая же, как у гелия. Но к ней добавили еще 1 электрон. Чуть позже станет понятно, для чего используется такая запись. Рисуем?
Черта проходит между энергетическими уровнями. Самый верхний уровень называется внешним. Именно он задает свойства химического элемента. Количество электронов на внешнем уровне равно номеру группы. Литий, который мы сейчас нарисовали, находится в 1 группе. У него на внешнем уровне сидит 1 электрон. Думаю, что бериллий нарисовать можно уже самостоятельно: просто добавить еще 1 электрон в гости к уже имеющемуся. И записать конфигурацию: 1s2 2s2. А вот два следующих элемента рассмотрим чуть подробнее. Потому что там у электрона есть выбор. Начнем с бора. Его электронная конфигурация 1 s2 2s22p1:

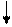

 Прежде чем перейти к углероду, надо ответить на следующие вопросы, а потом проверить себя по таблице Менделеева:
Прежде чем перейти к углероду, надо ответить на следующие вопросы, а потом проверить себя по таблице Менделеева:
Какой заряд ядра у атома бора?
Дата добавления: 2022-06-11; просмотров: 202; | Поделиться с друзьями:
|

Мы поможем в написании ваших работ!
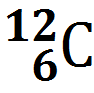
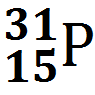
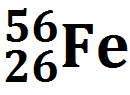

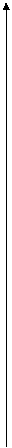
 Теперь хочется заселить эти оболочки электронами. То количества оболочек, на которых сидят электроны, равно номеру периода, в котором сидит наш элемент. Но мы не выяснили еще одну вещь: сколько электронов можно посадить на каждый уровень? Тут природа оторвалась как могла. Оказывается, вместимость разных уровней различна. Представим теперь, что на книжных полках есть ячейки для книг. Причем эти ячейки стоят не рядом, а немного различаются по высоте. На самом нижнем уровне такая ячейка одна. Ее обозначили буквой s. Почему? Да потому что орбиталь, в которой летает электрон с такой энергией, похожа на сферу! Так и запишем: 1 s. Цифра 1 означает, что наша орбиталь сидит на 1 этаже. Теперь поднимемся на 1 уровень выше. Там, как выяснилось, есть такая же орбиталь, как и на 1 этаже. Такая же ячейка. Но рядом, на небольшой ступеньке выше сидят еще 3 других, одинаковых между собой ячейки! И им соответствуют 3 новых орбитали! Как они выглядят — покажу позже. Их обозначают буквой р. Итого природа на 2 этаж ниспослала 1+3=4 орбитали. Напишем: 2 s – 1 шт, 2р – 3 шт. Поднимемся на 3 этаж. Там мы встретим 1 s – орбиталь, 3 р-орбитали и 5 d-орбиталей! Причем эти d-орбитали иногда поднимаются так высоко, что проламывают потолок и оказываются выше 4 этажа! Но эти случаи мы рассматривать не будем. И так далее, с каждым уровнем будет появляться нечетное число новых орбиталей. Теперь нарисуем схему, как оно выглядит. Эти ячейки можно рисовать квадратиками (слева), а можно просто горизонтальными черточками (справа). Это одно и то же.
Теперь хочется заселить эти оболочки электронами. То количества оболочек, на которых сидят электроны, равно номеру периода, в котором сидит наш элемент. Но мы не выяснили еще одну вещь: сколько электронов можно посадить на каждый уровень? Тут природа оторвалась как могла. Оказывается, вместимость разных уровней различна. Представим теперь, что на книжных полках есть ячейки для книг. Причем эти ячейки стоят не рядом, а немного различаются по высоте. На самом нижнем уровне такая ячейка одна. Ее обозначили буквой s. Почему? Да потому что орбиталь, в которой летает электрон с такой энергией, похожа на сферу! Так и запишем: 1 s. Цифра 1 означает, что наша орбиталь сидит на 1 этаже. Теперь поднимемся на 1 уровень выше. Там, как выяснилось, есть такая же орбиталь, как и на 1 этаже. Такая же ячейка. Но рядом, на небольшой ступеньке выше сидят еще 3 других, одинаковых между собой ячейки! И им соответствуют 3 новых орбитали! Как они выглядят — покажу позже. Их обозначают буквой р. Итого природа на 2 этаж ниспослала 1+3=4 орбитали. Напишем: 2 s – 1 шт, 2р – 3 шт. Поднимемся на 3 этаж. Там мы встретим 1 s – орбиталь, 3 р-орбитали и 5 d-орбиталей! Причем эти d-орбитали иногда поднимаются так высоко, что проламывают потолок и оказываются выше 4 этажа! Но эти случаи мы рассматривать не будем. И так далее, с каждым уровнем будет появляться нечетное число новых орбиталей. Теперь нарисуем схему, как оно выглядит. Эти ячейки можно рисовать квадратиками (слева), а можно просто горизонтальными черточками (справа). Это одно и то же.





















 И вот наш первый электрон скачет все ниже и ниже и допрыгивает до 1 уровня. Да, до того самого, который обозначается буквой К. И оседает там. На единственной s-орбитали, ибо другой нет. Напишем его домашний адрес: 1 s1. Что означает эта запись? На 1 уровне (большая цифра слева) есть s-орбиталь, на которой сидит 1 электрон (верхний индекс справа)! Вот такой простой адрес! Поскольку он сидит на s-орбитали, так его и назовем: s-электрон. Есть химический элемент, у которого всего 1 электрон. Это водород. Говорят, что это его электронная конфигурация. Ее можно нарисовать. Например, вот так:
И вот наш первый электрон скачет все ниже и ниже и допрыгивает до 1 уровня. Да, до того самого, который обозначается буквой К. И оседает там. На единственной s-орбитали, ибо другой нет. Напишем его домашний адрес: 1 s1. Что означает эта запись? На 1 уровне (большая цифра слева) есть s-орбиталь, на которой сидит 1 электрон (верхний индекс справа)! Вот такой простой адрес! Поскольку он сидит на s-орбитали, так его и назовем: s-электрон. Есть химический элемент, у которого всего 1 электрон. Это водород. Говорят, что это его электронная конфигурация. Ее можно нарисовать. Например, вот так:




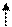
 Теперь рассмотрим электронную конфигурацию гелия. Заряд его ядра — +2, а значит, ему природой полагается 2 электрона. Кидаем второй электрон. Он может найти себе место на 1 уровне? Может. Только крутиться вокруг своей оси ему придется в сторону, противоположную соседу. И для того, чтобы на задерживаться на 2 уровне, он повернет свой спин куда надо. Теперь у нас на единственной 1s-орбитали живут два электрона. Как запишется такая электронная конфигурация? 1 s2. Теперь нарисуем ее, сначала квадратиками, а потом черточками:
Теперь рассмотрим электронную конфигурацию гелия. Заряд его ядра — +2, а значит, ему природой полагается 2 электрона. Кидаем второй электрон. Он может найти себе место на 1 уровне? Может. Только крутиться вокруг своей оси ему придется в сторону, противоположную соседу. И для того, чтобы на задерживаться на 2 уровне, он повернет свой спин куда надо. Теперь у нас на единственной 1s-орбитали живут два электрона. Как запишется такая электронная конфигурация? 1 s2. Теперь нарисуем ее, сначала квадратиками, а потом черточками:





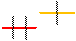















 Прежде чем перейти к углероду, надо ответить на следующие вопросы, а потом проверить себя по таблице Менделеева:
Прежде чем перейти к углероду, надо ответить на следующие вопросы, а потом проверить себя по таблице Менделеева:
