Безиндикаторное титрование меди (II) раствором ЭДТА
Челябинский государственный университет
Кафедра физической и аналитической химии
Лабораторная работа №4
«Фотометрическое титрование»
Выполнил:
Мастин И.С.
Группа Хб-202
Проверила:
Куваева А.О.
Челябинск, 2020 г.
Теоретическая часть
I. Сущность метода
Фотометрическое титрование — группа методов объёмного анализа, в которых конечная точка титрования определяется по изменению оптической плотности раствора в ходе химической реакции между титрантом и титруемым веществом.
При фотометрическом титровании может быть использовано все многообразие аналитических реакции: кислотно-основные, окислительно-восстановительные, реакции осаждения, комплексообразования, редокс – реакции, которые сопровождаются изменением абсорбционной способности раствора по отношению к электромагнитному излучению. Особенно широко здесь применяются реакции комплексообразования с аминополикарбоновыми кислотами и их солями.
Различают два варианта фотометрического титрования: титрование без индикатора и с одноцветным индикатором, титрование с двухцветным индикатором. В видимой области спектра титрование без индикатора возможно, если хотя бы один из компонентов аналитической реакции окрашен. Если для окрашенного компонента (компонентов) выполняется закон светопоглощения, то зависимость оптической плотности раствора от объема добавленного титранта (с учетом разбавления) выражается двумя пересекающимися прямыми линиями, т.е. кривые титрования прямолинейны. За конечную точку титрования принимают точку излома. Если ни один компонент реакции не окрашен, то применяют цветной индикатор, который изменяет окраску вблизи точки эквивалентности. В этом случае кривые титрования не линейны и за конечную точку титрования принимают точку перегиба кривой титрования.
|
|
|
Комплексонометрическое титрование без индикатора.
Чаще других в комплексономерии используют титрование металлов этилендиаминтетрауксусной кислотой или ее натриевой солью (Na2H2Y2). Аналитическая реакция имеет вид:
Me2++ H2Y2- ↔ MeYn-4 +2H+ (1.1)
Некоторые переходные металлы, в частности медь (II), образуют с ЭДТА – ионом окрашенные комплексы (CuY2- имеет максимум поглощения при λ = 750 нм). По мере добавления титранта выход окрашенного комплекса будет возрастать, и оптическая плотность раствора будет линейно увеличиваться. При добавлении титранта сверх эквивалентного количества оптическая плотность будет оставаться постоянной, так как выход комплекса перестанет увеличиваться (рис. 1).
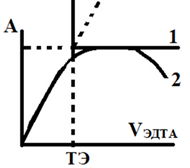
Рис. 1. Пример линейной кривой титрования: 1 – разведение практически отсутствует; 2 – при значительном разведении.
|
|
|
Если при титровании наблюдается кривая вида 2 (рис.1), то необходимо ввести поправку на разведение, то есть оптическую плотность раствора А умножить на величину (V+Vэдта)/V, где V – исходный объем титруемого раствора. Поскольку выход комплекса зависит от pH раствора, титрование необходимо вести в присутствии буфера.
Комплексонометрическое титрование с двухцветным индикатором.
Гораздо более чувствительными являются методы комплексонометрического титрования с органическими красителями – комплексообразователями, которые изменяют свою окраску при взаимодействии с металлом: Ind- + Men+ ↔ MeInd(n-1) (1.2).
Такими индикаторами, в частности, являются I – (2 – пиридилазо) – 2 – нафтол (ПАН) и 4 – (2 – пиридилазо) – резорцин (ПАР).
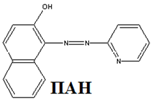
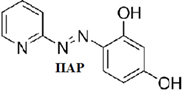
Положение равновесия (1.2), то есть отношение [Ind] и [MeInd(n-1)], а следовательно, и оптическая плотность раствора зависит от концентрации свободных ионов металла, которую удобно оценивать величиной pM. Индикатор вносят в раствор в количествах, много меньших общей концентрации металла. Поэтому при титровании комплексоном pM будет увеличиваться, изменяясь скачком вблизи точки эквивалентности (рис. 2).
|
|
|
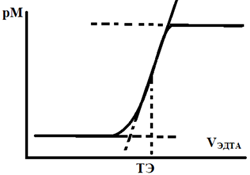
Рис. 2. Кривая фотометрического титрования с двухцветным индикатором.
Оптическая плотность раствора вдоль кривой титрования будет изменяться, так как будет изменяться pM. Действительно, из закона действующих масс для равновесия (1.2) запишем:
-lg([MeInd(n-1)]/[Ind-]) = pβMeInd + pM.
Однако в общем случае зависимость A от Vэдта отличается от зависимости pM от Vэдта, так как A и pM не пропорциональны друг другу, а связаны более сложным соотношением. Возможны три варианта кривых фотометрического титрования с металлоиндикатором, которые приведены на рис. 3.
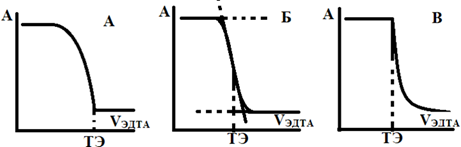
Рис. 3. Варианты кривых фотометрического титрования с металлоиндикатором.
Кривая (Б) соответствует случаю, когда точка эквивалентности находится в пределах перехода окраски индикатора: pMт.э. = рКМеInd±I. Кривая (А) наблюдается, когда относительная устойчивость окрашенного комплекса невелика: рКМеInd> pMт.э., a кривая (В) относится к случаю, когда: рКМеInd< pMт.э., то есть комплекс MeInd сравнительно прочен. Точку перехода окраски во всех случаях находят как точку перегиба при линейной экстраполяции участков кривых, как показано на рис. 3. Отнесение экспериментальной кривой титрования к одному из возможных типов кривых осуществляют экспериментально при титровании точного раствора металла. В случаях (Б) и (В) точка перегиба (точка конца титрования) несколько отличается от действительной точки эквивалентности из – за того, что часть ионов металла при этом еще связана в комплекс MeInd (индикаторная ошибка). Преимуществом фотометрического титрования перед визуальным является то, что индикаторную ошибку можно просчитать. Однако если удачно выбран pH (основная реакция (1.1) идет с большим выходом), исходная концентрация металла больше 1*10-3 М, а концентрация индикатора низка (1*10-5 М), то индикаторная ошибка пренебрежительно мала.
|
|
|
II. Реактивы и оборудование:
1. Стандартный раствор CuSO4, 0,05 моль/л.
2. Раствор CuSO4, 0,5 моль/л.
3. Стандартный раствор ЭДТА, 0,05 моль /л.
4.Ацетатный буферный раствор с pH = 5 (45 мл концентрированной HCl и 117 г NH4CH3COO растворяют в 1 л раствора).
5. Раствор индикатора ПАР водн., 0,1%.
6. Мерная колба емкостью 50 мл.
7. Пипетки емкостью 5 мл, 2 шт.; емкостью 2 мл, 1 шт.
8. Колориметр фотоэлектрический концентрационный КФК — 2.
Практическая часть
Безиндикаторное титрование меди (II) раствором ЭДТА
Поместили кювету в 2 мл 0,05 М раствора сульфата меди, 5 мл буферного раствора с pH = 5. Довели общий объем раствора водой до метки на кювете. Кювету поместили в кюветный отсек, отрегулировали обороты магнитной мешалки и титровать 0,05 М ЭДТА, дозируя порциями по 0,1 мл, при длине волны максимального светопоглощения комплекса CuY2- (λ = 750 нм) после добавления каждой порции титранта записывали значения коэффициента пропускания (T%). 100% пропускания установили предварительно по кювете с растворителем. Результаты оформили в виде таблицы 1.1.
Таблица 1.1.
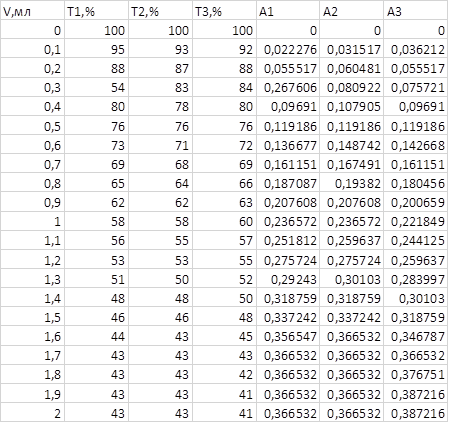

Строим графики зависимости A от объёма добавленного титранта (Vт):
A от V (1):
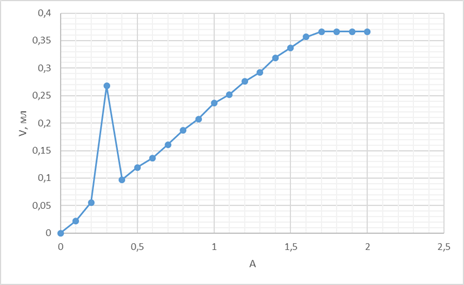
A от V (2):

A от V (3):
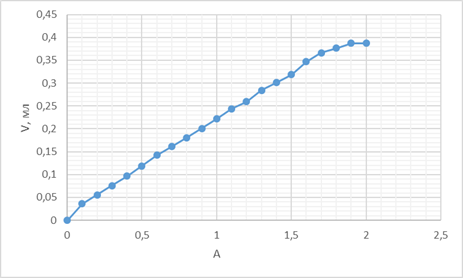
По данным графиков рассчитали концентрацию СuSO4:
C1 = (0,05*1,7)/2 = 0,0425 M
C2 = (0,05*1,6)/2 = 0,04 M
C3 = (0,05*1,9)/2 = 0,0475 M
Статистически обрабатываем:
Сср. = 0,0433 М
S = 0,0038
ΔC = 0,0094
Cср.±ΔC = (0,043±0,009) М
σ = (0,043-0,05)/0,05*100% = 14%
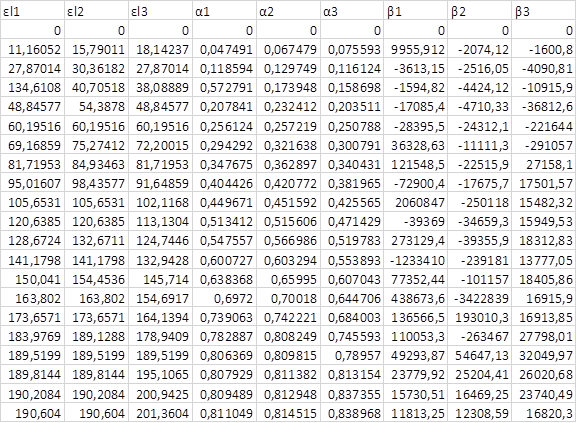
Для нахождения состава и условной константы устойчивости комплекса CuY2- построили графики зависимости εl от СТ/ССu:

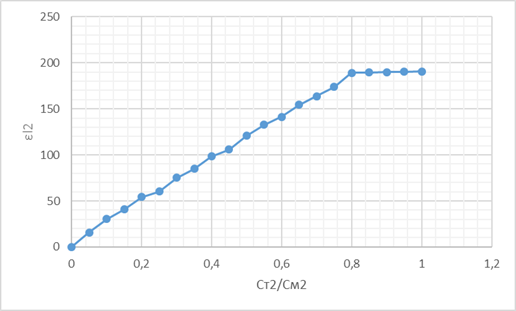
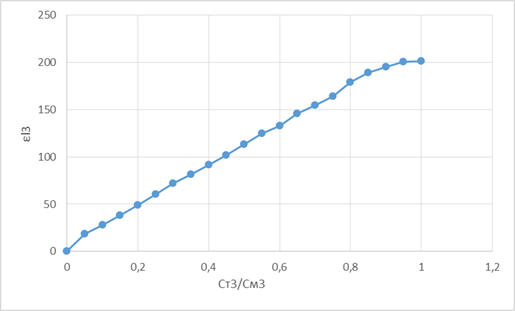
Убедились, что образуется комплекс состава Cu: ЭДТА = 1:1.
Нашли условную константу устойчивости:
β = α(CuY)/((1 - α(CuY))*(CT – α(CuY)*CCu)) = 1011
βтеор. = 1018,8 = 6,3*1018
Значение практической константы устойчивости меньше теоретической, а значит, комплекс менее устойчив.
Дата добавления: 2022-06-11; просмотров: 411; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
