Классификация и стадии развития гемолитической болезни
СУ в педиатрии. 1 семестр Лекция №5 Тема: Сестринский уход при наследственных заболеваниях и гемолитической болезни новорожденных..
1. Мотивация изучения темы: Период новорожденности – один из важнейших критических периодов ребенка, во время которого происходит адаптация организма ребенка к условиям внеутробной жизни. Скорость превращений различных функциональных систем организма в периоде новорожденности несравнима ни с одним из последующих возрастных этапов. Известно, что неонатальная смертность имеет наибольший удельный вес в структуре детской смертности, а потому снижение последней невозможно без существенного совершенствования выхаживания новорожденных. Поэтому важной задачей медицинских сестер становится осуществление правильного и качественного ухода за пациентами с гемолитической болезнью новорожденных и наследственными заболеваниями.
2. Ц ели занятия.
Учебные:
Знать:
- Определение, этиология ГБН, наследственных заболеваний.
- Классификация.
- Клинические проявления, лабораторные и инструментальные методы диагностики.
- Доврачебная помощь.
- Лечение и организация ухода.
- Профилактика.
Уметь:
- Осуществлять уход за новорожденным ребёнком с гемолитической болезнью новорожденных и наследственными заболеваниями;
- владеть навыками медсестринского обследования с целью выявления проблем пациента;
- владеть навыками всех видов инъекций;
|
|
|
- обеспечивать необходимую подготовку пациента к лабораторным и инструментальным методам диагностики;
- обеспечивать соблюдение постельного режима, диетотерапии;
- осуществлять текущую дезинфекцию и другие профилактические мероприятия;
- владеть навыками личной медицинской безопасности при уходе за пациентами
1. Наследственные заболевнаия.
Насле́дственные заболева́ния — заболевания, возникновение и развитие которых связано с различными дефектами и нарушениями в наследственном аппарате клеток. В основе наследственных заболеваний лежат мутации: хромосомные, генные и митохондриальные. Наследственные заболевания могут быть обусловлены мутациями, передаваемыми в семьях по наследству, или мутациями, вновь возникшими в клетках зародышевой линии, в зиготе или на очень ранних этапах развития. Наследственные болезни многочисленны (известно свыше 6000) и разнообразны по проявлениям.
Некоторые наследственные заболевания являются врождёнными. Врождённые наследственные болезни следует отличать от пороков развития, вызванных, например, инфекцией (сифилис или токсоплазмоз) или воздействием иных повреждающих факторов на плод во время беременности.
|
|
|
При наследственных заболеваниях могут иметь место генетические нарушения различного характера и локализации. Эти болезни могут быть связаны с нарушениями ядерной (хромосомной) или митохондриальной ДНК.
Соответственно, наследственные заболевания классифицируют как генные, хромосомные, митохондриальные.
Наследственные заболевания классифицируют также по типу наследования. Для значительной части наследственных болезней тип наследования установлен — патологические признаки, также как и нормальные, могут наследоваться аутосомно-доминантно, аутосомно-рецессивно и сцепленно с полом (Х-сцепленный доминантный, Х-сцепленный рецессивный и Y-сцепленный типы наследования). Термин «аутосомный» указывает на то, что мутантный ген локализован в аутосоме, «Х-сцепленный» — в половой Х-хромосоме, а «Y-сцепленный» — в половой Y-хромосоме. Выделение доминантного и рецессивного типов наследования существенно с медицинской точки зрения, так как при доминантном типе наследования клиническое проявление болезни обнаруживается у гомо- и гетерозигот, а при рецессивном — только у гомозигот, то есть значительно реже. Основные методы, с помощью которых устанавливается тот или иной тип наследования, — клинико-генеалогический, базирующийся на анализе родословных, и более точный сегрегационный анализ, объектом которого, как правило, являются так называемые «ядерные семьи» (то есть родители и дети).
|
|
|
Синдро́м Да́уна (трисомия по хромосоме 21) — одна из форм геномной патологии, при которой чаще всего кариотип представлен 47 хромосомами вместо нормальных 46, поскольку хромосомы 21-й пары, вместо нормальных двух, представлены тремя копиями.
При образовании половых клеток во время мейоза парные хромосомы должны расходиться, но если по какой-то причине этого не произошло, во время зачатия ребенка появляется третья 21-ая хромосома (трисомия).
Факторы риска рождения ребенка с синдромом Дауна Почему развивается синдромом Дауна, и что это такое? Основной фактор риска, повышающий вероятность появления ребенка с синдромом Дауна – это возраст будущей матери. В 45 лет риск рождения больного ребенка 1:30. Хотя, согласно статистике, дети с такой аномалией рождаются чаще у молодых женщин, что объясняется большим количеством родов. Возраст отца никак не влияет на возникновение патологии. Это связано с тем, что мужские половые клетки обновляются каждые 72 суток и не накапливают в себе токсичные вещества. У женщин же яйцеклетки содержаться в яичниках еще с момента рождения, и значит, контакты с вредными химическими веществами, радиацией, злоупотребление алкоголем и курением могут негативно на них отражаться.
|
|
|
Признаки и симптомы Синдрома Дауна. Обычно синдром Дауна определяется по ряду внешних симптомов, которые не сложно обнаружить у человека: плоское лицо с раскосыми глазами, как у монголоидной расы (раньше патология носила название «монголизм»); маленькая голова и короткая шея; широкие кисти рук с короткими пальцами и единичной поперечной складкой на ладони; короткие конечности; недоразвитые ушные раковины; наличие эпиканта – особой складки у внутреннего угла глаза, что прикрывает слезный бугорок и не переходит на верхнее веко; плоская широкая переносица и короткий нос; изменение радужной оболочки глаз и наличие на ней пятен Брушфильда – очаговых уплотнений соединительной ткани диаметром от 0,1 до 1 мм, имеющих желтый цвет; низкий рост; кожная складка на шее новорожденного; косоглазие; аномально большой язык (макроглоссия); мышечная гипотония; укорочение пальцев из-за недоразвития средних фаланг, а также дефект развития 5-го пальца (искривление); килевидная или воронкообразная форма грудной клетки; открытый рот в связи со сниженным тонусом мышц. У 40% детей с синдромом Дауна диагностируется врожденный порок сердца, что есть одной из главной причин их смертности. Часто с этой патологией также сочетается врожденный дефект ЖКТ – атрезия 12-ти перстной кишки. Могут наблюдаться признаки легкой или средней умственной недоразвитости.
Диагностика синдрома Дауна. Патологию обычно выявляют еще до рождения ребенка. Будущей матери предлагают пройти комплексный тест, который проводится между 11-й и 13-й неделей беременности, и между 15-й и 20-й неделей во втором триместре. Это так званный генетический скрининг, позволяющий выявить патологию еще на этапе внутриутробного развития. В первом триместре посредством ультразвука измеряются характерные зоны плода – носовая кость, толщина воротникового пространства. Подозрение на хромосомный дефект может появиться, если носовая кость не прослеживается или имеет очень маленькие размеры, а толщина воротничкового пространства более 3мм. Кроме этого в анализе крови беременной женщины измеряется количество хорионического гонадотропина человека и протеина РАРР-А. Итоги анализа крови и УЗИ трактуются вместе. Во втором триместре беременности анализ крови проверяют по трем показателям. Большое диагностическое значение имеет альфа-фетопротеин, свободный эстриол, хорионичный гонадотропин. Результаты дополнительного исследования сопоставляют с данными первого триместра. Даже самые лучшие диагностические методы иногда показывают ложноположительные результаты, когда ребенок абсолютно здоров. Если генетический скрининг выдал высокую вероятность рождения ребенка с синдромом Дауна, тогда показаны более серьезные анализы. Их после предварительной консультации может порекомендовать врач-генетик. К таким анализам относят: 1) Амниоцентез. Процедура проводится на 15-й неделе беременности посредством введения особой иглы в матку женщины для взятия пробы амниотической жидкости. Данный метод считается самым точным обследованием. 2) Исследование ворсинок хориона. Для хромосомного анализа отбираются плацентарные клетки. Тест информативен между 9-й и 14-й неделей беременности. 3) Анализ пуповинной крови. Проводится такое исследование после 18-й недели. Многие женщины отказываются проходить описанные выше процедуры, потому что возможно повреждение внутренних органов и большая вероятность выкидыша, особенно высокий риск при взятии крови из пуповины. Такие тесты, как правило, предлагают тем семьям, у которых наиболее большой процент возможности появления малыша с патологией. Инвазивные методы также не рекомендуется проводить, если возраст матери выше 35 лет. После того как ребенок появился на свет, в диагностических целях по показаниям назначают хромосомный анализ на наличие добавочных генетических частичек в 21-й паре хромосом.
Лечение и прогноз при Синдроме Дауна. На данный момент синдром Дауна – неизлечимая патология, но сопутствующие болезни, такие как порок сердца, например, можно с успехом лечить. При этой хромосомной аномалии очень часто диагностируется задержка развития нервной системы, поэтому в первом триместре беременной женщине рекомендуют принимать препараты фолиевой кислоты для снижения риска развития серьезных нарушений. После рождения ребенка, если он здоров, все усилия должны быть направлены на его социальную адаптацию. Существуют специальные реабилитационные центры, где с такими детьми занимаются логопеды-дефектологи и психологи. Для повышения результатов от специального обучения показаны ноотропные средства, которые стимулируют развития нервной системы. Это аминалон, витамины группы В, церебролизин. Пороки развития внутренних органов могут требовать проведения операций, но своевременное вмешательство увеличивает шансы на нормальную жизнь. Поэтому ребенок с хромосомным дефектом должен быть под постоянным контролем узких специалистов. Средняя продолжительность жизни людей с синдромом Дауна короче, чем у обычных людей, что связано с большой восприимчивостью к разного рода заболеваниям. В наше время, когда возможности медицины возросли, с этой патологией можно существовать и до 50 лет, а раньше такие дети редко доживали до десятилетнего возраста.
Фенилкетонури́я — редкое наследственное заболевание группы ферментопатий, связанное с нарушением метаболизма аминокислот, главным образом фенилаланина. При несоблюдении низкобелковой диеты сопровождается накоплением фенилаланина и его токсических продуктов, что приводит к тяжёлому поражению ЦНС, проявляющемуся, в частности, в виде нарушения умственного развития (фенилпировиноградной олигофрении). Одно из немногих наследственных заболеваний, поддающихся успешному лечению.
В большинстве случаев (классическая форма) заболевание связано с резким снижением или полным отсутствием активности печёночного фермента фенилаланин-4-гидроксилазы, который в норме катализирует превращение фенилаланина в тирозин.
Вследствие метаболического блока активируются побочные пути обмена фенилаланина, и в организме происходит накопление его токсичных производных — фенилпировиноградной и фениломолочной кислот, которые в норме практически не образуются. Кроме того, образуются также почти полностью отсутствующие в норме фенилэтиламин и ортофенилацетат, избыток которых вызывает нарушение метаболизма липидов в головном мозге. Предположительно, это и ведёт к прогрессирующему снижению интеллекта у таких больных вплоть до идиотии.
Производится полуколичественным тестом или количественным определением фенилаланина в крови. При нелеченных случаях возможно выявление продуктов распада фенилаланина (фенилкетонов) в моче (не ранее 10—12 дня жизни ребёнка). Также возможно определение активности фермента фенилаланингидроксилазы в биоптате печени и поиск мутаций в гене фенилаланингидроксилазы. Для диагностики 2 и 3 типа, связанных с мутацией в гене, отвечающем за синтез кофактора, необходимы дополнительные диагностические исследования.
В возрасте от 2—4 месяцев у больных появляются такие симптомы, как вялость, судороги, гиперрефлексия, «мышиный» запах пота и мочи или «запах волка», экзема. А также среди других симптомов отмечены: мышечная гипертензия, гиперкинезы, неустойчивая походка, при несоблюдении диеты светлеют глаза, волосы, кожа (по причине недостаточного количества в организме меланина, производного тирозина); судорожные припадки.
Фенилкетонурия сопровождается глубокой степенью умственной отсталости (дебильность, имбецильность, идиотия), обычно идиотией или имбецильностью. Могут наблюдаться явления эхопраксии (повторение движений окружающих) и эхолалии (повторение речи). Для больных фенилкетонурией характерна вялость с редкими вспышками злобы и раздражительности.
При своевременной диагностике патологических изменений можно полностью избежать, если с рождения и до полового созревания ограничить поступление в организм фенилаланина с пищей.
Позднее начало лечения хотя и даёт определённый эффект, но не устраняет развившихся ранее необратимых изменений ткани мозга.
Некоторые из современных газированных напитков, жевательных резинок и лекарственных препаратов содержат фенилаланин в форме дипептида (аспартам), о чём производители обязаны предупреждать на этикетке. Так, например, на этикетках ряда безалкогольных напитков после указания состава и пищевой ценности 100 мл напитка приводится следующее предупреждение: «Содержит источник фенилаланина. Противопоказано применение при фенилкетонурии».
При рождении ребёнка в роддомах на 3—4 сутки берут анализ крови и проводят неонатальный скрининг для обнаружения врождённых заболеваний обмена веществ. На этом этапе возможно обнаружение фенилкетонурии, и, как следствие, возможно раннее начало лечения для предотвращения необратимых последствий.
Лечение проводится в виде строгой диеты от обнаружения заболевания как минимум до полового созревания, многие авторы придерживаются мнения о необходимости пожизненной диеты. Диета исключает мясные, рыбные, молочные продукты и другие продукты, содержащие животный и, частично, растительный белок. Дефицит белка восполняется аминокислотными смесями без фенилаланина. Кормление грудью детей, больных фенилкетонурией, возможно и может быть успешным при соблюдении некоторых ограничений.
Расчет диеты для больного фенилкетонурией проводит врач с учётом потребности в фенилаланине и его допустимом количестве.
2. Гемолитическая болезнь новорождённого (ГБН) — это заболевание, при котором эритроциты новорождённого разрушаются антителами матери, из-за несовместимости крови матери и ребёнка по антигенам эритроцитов, чаще всего по резус-фактору и системе групп крови, реже по другим факторам крови.
Для полного понимания, что такое гемолитическая болезнь, необходимо знать значение некоторых терминов:
- Антиген — это любое вещество, которое организм воспринимает как чужеродное и против которого вырабатывает антитела.
- Антитела — это белковые молекулы, с помощью которых организм нейтрализует чужеродные клетки.
- Антигены эритроцитов (эритроцитарные антигены) — это молекулы, которые находятся на поверхности эритроцитов.
- Гемолиз — разрушение эритроцитов.
Известно более 250 эритроцитарных антигенов, которые образуют более 20 антигенных систем. Однако наиболее важное клиническое значение имеют антигены резус-фактора (Rh) и системы групп крови (АВ0).
Система резус-фактора
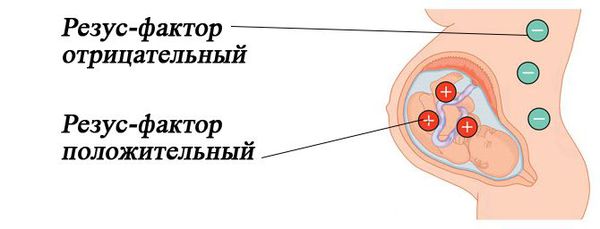
Резус-фактор — белок, который может содержаться на поверхности эритроцитов. Кровь считается резус-положительной (Rh+), если на эритроцитах есть резус-фактор (антиген D). Если этого антигена на эритроцитах нет, то кровь является резус-отрицательной (Rh-). У большинства людей кровь резус-положительная.
Резус-несовместимость возникает тогда, когда у матери резус-отрицательная кровь, а у ребёнка резус-положительная. В этом случае иммунная система матери может распознавать эритроциты плода как "инородные" и потенциально опасные и вырабатывать антитела против резус-фактора на эритроцитах плода. Антитела прикрепляются к эритроцитам ребёнка и разрушают их (происходит гемолиз). Этот процесс начинается в период его внутриутробного развития и продолжается после рождения. Если плод имеет резус-отрицательную кровь, а мама резус-положительную, конфликта не возникает.
Система групп крови
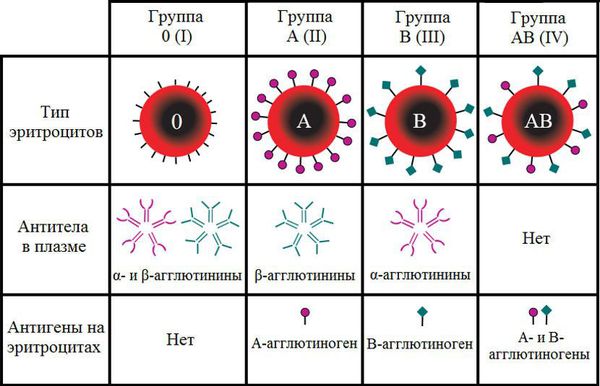
Группа крови — это определённое сочетание врождённых антигенов на поверхности эритроцитов и антител в плазме крови. Двумя основными антигенами эритроцитов являются А и В. Группы крови определяются на основании наличия или отсутствия этих антигенов. Одноимённые антитела обозначаются греческими буквами α и β.
Кровь любого человека может одновременно содержать только противоположные антигены и антитела или не иметь каких-то из них. В противном случае должна произойти агглютинация (склеивание) клеток крови. Этот процесс может привести к летальному исходу из-за формирования тромбов и закупорки кровеносных сосудов.
В зависимости от сочетания антигенов и антител различают четыре группы крови по системе АВ0.
Несовместимость по системе групп крови (АВ0) может возникнуть, если у матери I (О) группа крови, а у плода II (A) или III (B). В этом случае организм матери производит антитела к А или B антигенам, которые могут проникнуть через плаценту, присоединиться к эритроцитам плода и вызвать их разрушение (гемолиз). В результате у плода развивается анемия, однако она менее тяжёлая, чем при резус-несовместимости. В связи с этим несовместимость по системе групп крови не всегда диагностируют и существует предположение, что встречается она намного чаще.
Среди перинатальной смертности гемолитическая болезнь новорождённых занимает 5 место.
Группы риска по развитию данной патологии:
. Дети, имеющие A (II), B (III) или AB (IV) группы крови, рождённые от матерей с 0 (I) группой крови.
. Дети с резус-положительным фактором, рождённые от матерей с резус-отрицательным фактором.
. Дети с редкими антигенами, определяющими группу крови или резус-фактор, рождённые от матерей, у которых отсутствуют данные антигены.
Классификация и стадии развития гемолитической болезни
Классификация по виду иммунологической несовместимости эритроцитов матери и плода:
- несовместимость по резус-фактору;
- несовместимость по системе АВ0 (групповая несовместимость);
- несовместимость по редким факторам крови (RhC, Rhc, RhE, Rhe).
Классификация по ведущим клиническим проявлениям:
- отёчная форма (наиболее тяжёлая);
- желтушная форма (в зависимости от выраженности желтушного синдрома степень ГБН может быть лёгкой, средней и тяжёлой);
- анемическая форма (чаще всего является проявлением лёгкой степени тяжести).
По наличию или отсутствию осложнений:
- неосложнённая форма;
- осложнённая форма (билирубиновая энцефалопатия, синдром сгущения желчи, геморрагический синдром, обменные нарушения).
По степени тяжести:
- Лёгкая степень. Включает в себя незначительные клинические проявления или их отсутствие, лабораторные признаки ГБН. При наличии желтушного синдрома дети нуждаются в фототерапии.
- Средняя степень. Включает в себя клинические и лабораторные проявления ГБН. Дети нуждаются в непрерывной фототерапии, в некоторых случаях — в операции заменного переливания крови.
- Тяжёлая степень. Наличие выраженных клинических проявлений с нарушением работы органов и систем. Выраженные лабораторные изменения, при которых дети нуждаются в интенсивном лечении и операции заменного переливания крови.
Клиника. Во время беременности признаки несовместимости крови матери и плода не проявляются.
Клиническая картина гемолитической болезни новорождённых зависит от проявления одной из трёх форм: анемической, желтушной и отёчной. Но может иметь место сочетание клинических форм.
1. Анемическая форма ГБН. Является наиболее лёгкой формой и проявляется бледностью кожных покровов, неврологическими нарушениями (вялость: ребёнок неохотно сосёт грудь, много спит) и признаками увеличения печени и селезёнки, которые наблюдаются в динамике.
2. Желтушная форма ГБН. Встречается чаще всего — до 90 % случаев [8]. Основной симптом в этом случае — желтуха. Кожа и видимые слизистые оболочки становятся жёлтыми в первые часы после рождения (до 24 часов), также могут быть увеличены печень и селезёнка (гепатоспленомегалия). Степень тяжести желтушной формы будет зависеть от интенсивности (яркости) и распространённости желтухи на теле новорождённого, что доктор может определить визуально с помощью шкалы Крамера.
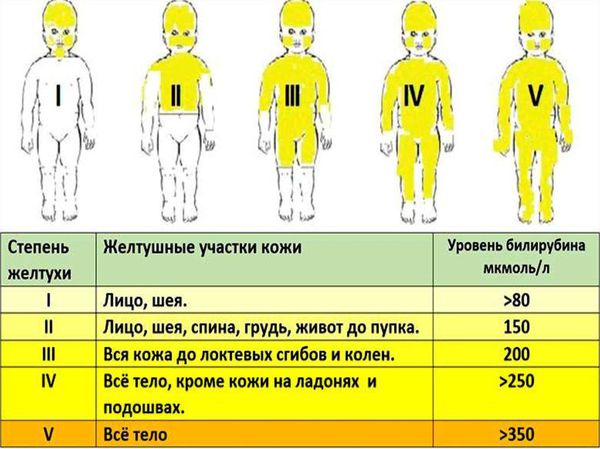
Интенсивность желтухи будет зависеть от уровня билирубина (жёлчного пигмента, который образуется при разрушении эритроцитов). Именно билирубин окрашивает кожу в жёлтый цвет. При достижении критических цифр этот фермент может поражать нейроны головного мозга, что приводит к повреждению его структур и развитию грозного осложнения — билирубиновой энцефалопатии (ядерной желтухи).
3. Отёчная форма ГБН ("водянка плода"). Является наиболее тяжёлой формой заболевания. В большинстве случаев она диагностируется ещё внутриутробно. При рождении обращают на себя внимание желтушно окрашенные плодные оболочки, околоплодные воды, первородная смазка и пуповина. С первых минут жизни ребёнок находится в тяжёлом состоянии, для которого характерны выраженные отёки, распространённые по всему телу: подкожный отёк (анасарка), в области живота и органов брюшной полости (асцит), в области грудной клетки (гидроперикард)
Дата добавления: 2022-06-11; просмотров: 12; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
