Электролитическая проводимость
Электрическая проводимость раствора электролита характеризует его способность проводить электрический ток.

где R– сопротивление электролита, Ом;
ρ – удельное сопротивление;
S– площадь электродов, м2;
l– расстояние между электродами, м.
Растворы электролитов обладают ионной проводимостью, т.е. электропроводимость растворов электролитов обусловлена перемещением ионов в электрическом поле.
Различают:
- удельную
- эквивалентную (молярную) электропроводимости.
Удельная электропроводимость (æ), представляет собой величину, обратную удельному сопротивлению (ρ).
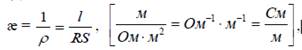
Удельной электропроводимостью называется электропроводимость раствора электролита, заключенного между электродами площадью 1 м2 каждый, находящимся на расстоянии 1 м друг от друга.Единица измерения Сименс/м.
Удельная электропроводимость растворов электролитов зависит от концентрации раствора, температуры, давления, скорости движения ионов и заряда ионов (природы растворителя и природы электролита).
Влияние температуры. Повышение температуры на 1о увеличивает удельную электропроводимость на 2-2,5%. Это объясняется понижением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов увеличением их степени диссоциации.
Влияние концентрации раствора. Зависимость удельной электропроводимости от концентрации для различных электролитов проходит через максимум. В очень разбавленных растворах взаимодействия между ионами практически отсутствуют, поэтому с увеличением концентрации удельная электропроводимость возрастает.
|
|
|
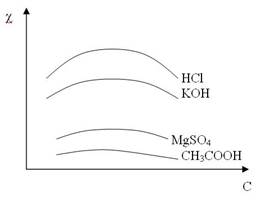 При дальнейшем увеличении концентрации раствора понижение удельной электропроводимости слабых электролитов обусловлено главным образом уменьшением степени электролитической диссоциации электролита.
При дальнейшем увеличении концентрации раствора понижение удельной электропроводимости слабых электролитов обусловлено главным образом уменьшением степени электролитической диссоциации электролита.
Сильные электролиты в растворах при всех концентрациях диссоциированы полностью (α =1). Для них уменьшение электропроводимости объясняется межионными взаимодействиями.
Сильные электролиты
1. Зависимость сильно выражена.
2. С увеличением С величина χ увеличивается за счет увеличения количества ионов в растворе.
3. Дальнейшее увеличение С приводит к уменьшению χ за счет уменьшения скорости движения ионов вследствие их большого количества и межионного взаимодействия.
Слабые электролиты
1. Зависимость слабо выражена.
2. С увеличением С величина χ увеличивается за счет увеличения количества ионов в растворе.
3. Дальнейшее увеличение С приводит к уменьшению χ за счет того, что с ростом С α падает и количество ионов уменьшается.
|
|
|
Эквивалентной электрической проводимостью λ называется электропроводимость раствора электролита, содержащегося 1 г-эквивалент растворенного вещества, заключённого между двумя параллельными электродами, площадью 1 м2 и находящимися на расстоянии 1 м друг от друга; [См·м2 /·г-экв].
Связь между эквивалентной λ и удельной æ электропроводностью определяется соотношением:
λ = æ / С,
где С – эквивалентная концентрация электролита (г-экв/м3).
Кроме эквивалентной электропроводности в электрохимии используется также молярная электропроводимость, когда раствор содержит 1 моль растворённого вещества, обозначается также λ, [См·м2 /·моль].
Для размерности концентрации раствора, выраженной в моль/л или моль/дм3, соотношение (λ= æ /С) нужно записывать в виде λ = (æ ·1000) / С.
С увеличением разведения (V= 1/С) эквивалентная электропроводимость как сильных, так и слабых электролитов возрастает и достигает некоторого предельного значения, которое называется электропровод им остью при бесконечном разведении (λо ). Для слабых электролитов λ0 экспериментально не достигается.
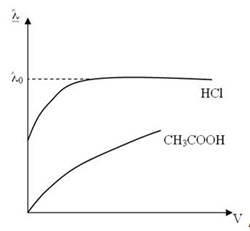 Для сильных электролитов наблюдается сначала резкое увеличение λ, затем электропроводимость изменяется мало.
Для сильных электролитов наблюдается сначала резкое увеличение λ, затем электропроводимость изменяется мало.
|
|
|
Для слабых электролитов наблюдается медленный, но непрерывный рост эквивалентной электропроводимости.
Для слабых электролитов отношение эквивалентной электропроводимости к эквивалентной электропроводимости при бесконечном разведении равно степени диссоциации:
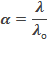
Для разбавленных растворов сильных электролитов зависимость эквивалентной электропроводимости от концентрации С описывается эмпирической формулой (уравнением) Кольрауша:
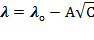
где А - константа при данной температуре и для данного растворителя, значение которой тем выше, чем больше заряд ионов, на которые распадается молекула электролита.
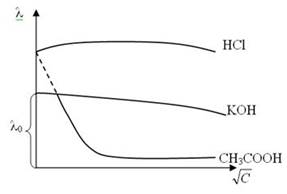
Строя график зависимости λ от 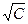 и экстраполируя ее на С = 0, по отрезку на оси λ определяем величину λ0. Для слабых электролитов формула Кольрауша не выполняется, зависимость нелинейная.
и экстраполируя ее на С = 0, по отрезку на оси λ определяем величину λ0. Для слабых электролитов формула Кольрауша не выполняется, зависимость нелинейная.
Уравнение Аррениуса: λ = Fα(Uк + Ua), где F - число Фарадея, α – степень электролитической диссоциации, показывает, что молярная электропроводимость растворов зависит от абсолютных скоростей движения катиона и аниона.
Ф.Кольрауш экспериментально показал, что в предельно разбавленных растворах электролитов каждый ион вносит свой независимый вклад в молярную электропроводность: λо = λо+ + λо- ,
|
|
|
где λо+ и λо ̅ - эквивалентная (или молярная) электропроводимость катиона и аниона при бесконечном разведении и называются электролитическими подвижностями.
Закон был открыт Кольраушем в 1879 г: эквивалентная (молярная) электропроводность бинарного электролита при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона.
При С → 0 α →1 уравнение Аррениуса принимает следующий вид:
λо = F(Uk+Ua )=FUк+FUa, т.е λо+ = FUк и λо ̅= FUа
Отсюда электролитическая подвижность иона равна произведению числа Фарадея на абсолютную скорость движения иона.
Кондуктометрия
Метод измерения электропроводимости, основанный на определении электрической проводимости растворов электролитов, называется кондуктометрией.
Кондуктометрия определяется как совокупность электрохимических методов анализа, основанных на измерении электропроводимости в жидких растворах электролитов, пропорциональной их концентрации.
Достоинства методов:
– высокая чувствительность, нижняя граница определяемых концентраций ~10-4–10-5 М;
– высокая точность, относительная погрешность определения составляет 0,1–2 %.
Кондуктометрический анализ проводится прямой кондуктометрией и кондуктометрическим титрованием.
Дата добавления: 2022-06-11; просмотров: 145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
