Абсолютная скорость движения ионов
Опорный конспект лекций по теме
«Электрохимия. Растворы электролитов»
Контрольные вопросы:
Гипотеза Аррениуса и современная теория электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Равновесие в растворах электролитов. Константа диссоциации слабых электролитов. Закон разведения Оствальда. Изотонический коэффициент Вант-Гоффа и степень диссоциации. Основные положения теории сильных электролитов. Понятие об эффективных концентрациях (активностях) ионов. Коэффициент активности. Правило ионной силы раствора.
Удельная и эквивалентная электропроводимости, зависимость их от концентрации для сильных и слабых электролитов. Подвижность ионов. Ее зависимость от температуры и концентрации. Закон независимого движения ионов (закон Кольрауша).
Электролитами называют вещества или системы, содержащие в заметных количествах ионы и обладающие ионной проводимостью. Различают твердые электролиты, расплавы и растворы электролитов.
Электролиты, молекулы которых в растворителе распадаются на два иона, называются бинарными или симметричными.
Если оба иона однозарядные, то электролит относят к типу бинарных одно-одновалентных (LiCl, NaOH, AgI и др.),
если двузарядные – к типу бинарных дву-двувалентных электролитов (MgSO4, ZnCO3, CaSO3 и др.).
Для несимметричных электролитов его тип устанавливается также по зарядам ионов: K2SO4 – относят к типу одно-двувалентных, MgCl2 – к типу дву-одновалентных.
|
|
|
Процесс распада вещества на ионы называется электролитической диссоциацией.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, согласно которой:
- электролиты в растворах распадаются на ионы – диссоциируют;
- диссоциация является обратимым равновесным процессом;
-силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Теория Аррениуса объясняет многие свойства слабых электролитов при низких концентрациях. Ряд явлений в концентрированных растворах теория объяснить не может, т.к. необходимо учитывать взаимодействие ионов друг с другом и некоторые другие факторы.
По современным представлениям причиной электролитической диссоциации являются процессы взаимодействия молекул электролита с полярными молекулами растворителя. Диссоциация зависит от множества факторов, которые можно разделить на группы:
- параметры растворенного вещества.
- параметры растворителя,
-состав раствора, присутствие в нем третьих веществ,
-внешние факторы, такие как давление и температура.
|
|
|
По способности образовывать ионы в растворе электролиты условно делят на сильные и слабые.
Сильные электролиты практически полностью диссоциируют на ионы. Это большинство неорганических кислот и щелочей (HCl, H2SO4, HNO3, HJ, KOH, Ca(OH)2, NaOH) и почти все соли, кроме ацетата свинца, каломели HgCl2, CdCl2.
Слабые электролиты частично распадаются на ионы. Это большинство органических кислот, вода, фенолы, амины. Из неорганических соединений к слабым электролитам относятся – NH4OH, HCN, H2S, H2SiO3, H2CO3.
Способность вещества диссоциировать на ионы определяется степенью электролитической диссоциации α.
Степенью электролитической диссоциации α называется отношение числа молекул распавшихся на ионы к общему числу молекул. Значение α всегда меньше единицы (0 <α <1).
Степень электролитической диссоциации зависит:
· От природы электролита:
| α = 0 | неэлектролиты |
| α < 0,03 | слабые электролиты |
| 0,03 < α < 0,3 | средние электролиты |
| α > 0,3 | сильные электролиты |
· От температуры.
С повышением температуры степень электролитической диссоциации увеличивается.
· От концентрации.
С повышением концентрации степень диссоциации уменьшается, и наоборот.
· От присутствия одноименных ионов.
|
|
|
Степень электролитической диссоциации слабого электролита при внесении в его раствор сильного электролита с одноименным ионом уменьшается.
Поскольку, при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами (свойства растворов, которые определяются природой растворителя и концентрацией раствора):
-повышение температуры кипения,
-понижение температуры замерзания,
-осмотическое давление для них всегда больше, чем вычисленные.
Для описания свойств растворов электролитов Вант-Гофф ввел поправку в уравнения, описывающие коллигативные свойства растворов неэлектролитов. Эта поправка называется изотоническим коэффициентом (i).
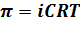
Для неэлектролитов i равен 1. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением i растет.
iхарактеризует отклонение свойств раствора электролита от свойств идеального раствора.
i связан со степенью диссоциации электролита: i = 1+α(υ – 1), где υ – количество ионов, на которые диссоциирует молекула.
i показывает во сколько раз общее число молекул и ионов в растворе больше числа молекул по диссоциации.
|
|
|
Слабые электролиты
В 1888 г. В. Оствальд установил, что процесс диссоциации слабых электролитов подчиняется закону действующих масс, т.е. процесс диссоциации слабых электролитов является обратимым.
Поскольку молекулы не полностью распадаются на ионы, то устанавливается равновесие между ионами и недиссоциированными молекулами.
Для электролита АВ уравнение процесса диссоциации можно записать так:
АВ → А+ + В ̄
Равновесие может количественно характеризоваться константой равновесия, называемой в данном случае константой диссоциации, которая зависит от природы электролита и температуры, но не зависит от концентрации.
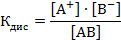
Для бинарного электролита [А+] = [В ̄ ] = α·С, а [АВ] = С(1 – α). Тогда константа диссоциации равна:
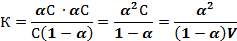
Закон разведения Оствальда
где С - молярная концентрация V=1/ C – величина обратная концентрации, называемая разведением.
Для разбавленных растворов можно считать, что 1 – α = 1, тогда
КДИС=α2·С
Очевидно, что чем больше КДИС, тем выше степень диссоциации электролита. Закон разведения Оствальда носит приближенный характер и справедлив для низких концентраций, может применяться только для бинарных электролитов.
В настоящее время электролиты на сильные и слабые делятся по следующим признакам:
· Слабые электролиты: 0 < α <1. Процесс диссоциации является обратимым, и поэтому Кдис = Кравн и она не зависит от концентрации.
· Сильные электролиты: α = 1 при любых концентрациях. Процесс диссоциации необратим. Понятие Кравн не применимо и признаком этого является Кдис, которая зависит от концентрации.
Сильные электролиты
1. Сильные электролиты в растворах любых концентраций находятся только в виде ионов.
2. Ионы в растворе электростатически взаимодействуют друг с другом.
Для сильных электролитов степень диссоциации равна единице, т.е. вещества диссоциируют полностью. Ионы сильного электролита в растворе электростатически взаимодействуют между собой и хаотически движутся. Вокруг каждого иона образуется ионная атмосфера, состоящая преимущественно из ионов противоположного знака. Все ионы в растворе равноценны, поэтому каждый ион может быть центром ионной атмосферы и входить в другие ионные атмосферы.
При хаотическом движении сфера разрушается и образуется вновь за время релаксации (время, в течение которого сфера не разрушается, если из нее удалить центральный ион). Ионная атмосфера обладает шаровой симметрией, поэтому заряд центрального иона равен по величине и противоположен по знаку заряду сферы.
Ионная атмосфера ограничивает движение ионов, уменьшает силу их взаимодействия и кажущаяся концентрация ионов меньше, чем реальная. Для точного описания состояния раствора и количественных расчетов нужно брать не общую концентрацию вещества, а эффективную концентрацию вещества или иона, в соответствии с которой они проявляют себя в химических реакциях или физико- химических процессах. Эта величина называется активностью (а). Понятие активности ввел Льюис.
Активность компонентов (а) раствора – это эффективная (кажущаяся), исправленная концентрация компонентов с учётом различных взаимодействий между ними в растворе. С помощью активности можно описывать термодинамику реальных растворов соотношениями, полученными для идеальных растворов при замене концентрации на активность.
Активность отличается от концентрации (m) на некоторую величину, пропорциональную коэффициенту активности (γ).
Из выражения а = γ m следует, что отношение активности (а) компонента к его концентрации (m) называют коэффициентом активности (γ): γ = а /m, γ ≤ 1.
γ - безразмерная величина.
Коэффициент активности (γ) есть мера отклонений свойств реального раствора от идеального.
В растворе электролита есть и катионы, и анионы. Для бинарного одно-однозарядного электролита, который диссоциирует по схеме KA → K+ + A-, общее число образующихся ионов ν = ν+ + ν-. Моляльности катиона (m+) и аниона (m–) в растворе электролита определяются по выражениям:
m+= m· ν+ и m= m–· ν–
где ν+ и ν- – число катионов и анионов, образующихся при диссоциации одной молекулы электролита.
Активности катиона (a+) и аниона (a–)равны: а+ = m +∙γ+, а- = m–· γ-
где γ+ и γ– – коэффициенты активности катиона и аниона.
Так как нельзя приготовить раствор, содержащий только катионы или только анионы, то нельзя определить активность анионов или активность катионов, поэтому введена среднеионная активность: а± = m± γ±
Правило ионной силы
Концентрацию растворов сильных электролитов можно описать не только активностью (а), но и ионной силой (I). Активность определяет концентрацию одного электролита в растворе, а через ионную силу можно выражать концентрацию как одного, так и нескольких электролитов. Ионная сила показывает суммарную концентрацию всех электролитов в растворе с учетом взаимодействия между ионами.
Ионная сила раствора I мера интенсивности электрического поля, создаваемого ионами. Электролиты, молекулы которых распадаются на многовалентные ионы, оказывают бoльшее влияние на ионные коэффициенты активности, чем ионы одновалентных электролитов. От величины ионной силы раствора (I) зависит значение среднего коэффициента активности электролита (γ±). Эта зависимость выражается правилом ионной силы. Согласно правилу ионной силы, коэффициенты активности ионов не зависят от вида ионов в растворе, а зависят от ионной силы (I) последнего.
Чтобы учесть это влияние, Льюис вместо обычных концентраций ввёл величину ионной силы раствора (I), которая для растворов сильных электролитов, содержащих i типов ионов с моляльностью mi и зарядами zi , определяется уравнением:
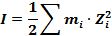
Ионная сила ( I) сильных электролитов определяется как полусумма произведений концентраций на квадрат заряда всех ионов, присутствующих в растворе:
Эта формула может быть использована для расчета ионной силы раствора одного или нескольких электролитов.
Например,
для электролита с концентрацией 0,2 моль/кг MgCl2 с учётом mi= m ν i
I =1/2 ∙ (0,2 ∙22 + 0,4 ∙12) = 0,6.
Для раствора 0,02 моль/кг AlCl3 ионная сила:
I =1/2∙(0,02 ∙32 + 0,06∙12) = 0,12.
По ионной силе можно определить среднеионный коэффициент активности γ± .
Теория Дебая-Хюккеля дает уравнение для расчета среднеионного коэффициента активности в первом приближении (применимо для растворов с концентрацией до 0,01М):
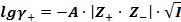
А – коэффициент, зависящий от диэлектрической проницаемости растворителя (ε) и температуры (Т), Z -зарядовое число ионов (без учета знаков).
Для разбавленных 1:1 валентных электролитов
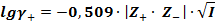
Правило ионной силы Льюиса и Рендалла – в разбавленных растворах γ± данного электролита зависит только от ионной силы раствора и не зависит от вида других ионов, находящихся в растворе.
Это правило выполняется при I ≤ 0,02, но приближенно им можно пользоваться и для расчетов с большей ионной силой.
Абсолютная скорость движения ионов
При наложении внешнего электрического поля на хаотичное тепловое движение ионов накладывается ориентированное поступательное движение к поверхности электродов. На скорость передвижения катионов (νк) и анионов (νа) влияют:
- размер иона: чем меньше ион (гидратированный ион), тем он более подвижен;
- заряд иона: скорость движения тем больше, чем выше его заряд;
- напряженность электрического поля Е (отношение разности потенциалов между электродами к расстоянию между ними); чтобы исключить влияние этого фактора, принято сравнивать абсолютные скорости движения ионов (U+, U-).
Абсолютной скоростью иона называют скорость его передвижения в поле с напряженностью 1В/м:
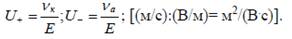
- концентрация электролита: с уменьшением концентрации электролита в растворе абсолютные скорости ионов растут;
- температура: при более высокой температуре скорость иона возрастает, так как снижается вязкость раствора;
- аномально высокими значениями абсолютных скоростей в водных растворах обладают ионы Н3О+ и ОН ̅. Это принято объяснять особым механизмом движения этих ионов в водных растворах – эстафетным. Между ионами гидроксония Н3О+ и молекулами воды Н2О, а также гидроксид-ионами ОН ̅ и Н2О происходит обмен Н+. Эти процессы протекают с огромной скоростью – средняя продолжительность существования иона составляет около 10-11с. В отсутствие внешнего поля такой обмен протекает в любых направлениях; под действием электрического поля передача ионов Н+ происходит направленно.
В растворах электролитов носителями заряда являются как катионы, так и анионы. Для оценки участия данного вида ионов в переносе электричества пользуются понятием числа переноса ионов.
Числом переноса ионов называется отношение количества электричества, перенесенного ионами данного вида, к общему количеству электричества, прошедшего через электролит, т.е. числа переноса показывают долю электричества, переносимую данным видом ионов.
Для бинарного электролита числа переноса для катиона и аниона выражаются следующими уравнениями:
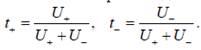
Дата добавления: 2022-06-11; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
