Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа.
Давление газа. Основное уравнение МКТ газа.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м2 действует сила давления в 1 Н, называется Паскалем.
1мм. рт. ст. = 133 Па
1атм = 1ž105 Па
(Давление газа - это результат ударов молекул газа о стенки сосуда)
Выведем основное уравнение молекулярно-кинетической теории газов.
газов 
Пусть в некотором объеме есть молекулы, масса каждой mo , их число равно N, и движутся они со скоростью V (очевидно, что скорости у всех молекул различны, однако среднее значение модуля скорости v вполне определенное) При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку, а значит и давление.
От чего же зависит давление газа?
Во-первых, от массы: чем больше масса молекулы, тем сильнее удар, значит здесь прямая пропорциональная зависимость давления от массы .Запишем: 1) р mo
|
|
|
Во-вторых, от скорости: чем быстрее движутся молекулы, тем сильнее будут удары, а значит и давление.: 2) р V
В-третьих, есть еще одна зависимость от скорости: чем быстрее движутся молекулы, тем чаще удары, а значит и давление.Запишем: 3) р v
В-четвертых, давление газа зависит от числа молекул в данном сосуде, а точнее от концентрации n. Концентрация – физическая величина, равная числу молекул, содержащихся в единице объема (n = N/V ) Запишем: 4) р n
В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы
Это и есть основное уравнение молекулярно-кинетической теории идеального газа. В этом уравнении коэффициент 1/3 означает, что в трехмерном пространстве только треть молекул участвует в движении в определенном направлении (по оси х, например).
Это уравнение можно записать по-другому, если умножить и разделить правую часть уравнения на 2. P = 2/3· n·Ек, где Ек = mo·v2 /2
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул
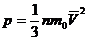 или
или  где р — давление газа; n — концентрация молекул газа (число его молекул в единичном объеме): m0 — масса молекулы газа,
где р — давление газа; n — концентрация молекул газа (число его молекул в единичном объеме): m0 — масса молекулы газа,  — средняя квадратичная скорость движения газовых молекул;
— средняя квадратичная скорость движения газовых молекул; 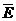 —средняя квадратичная энергия поступательного движения молекул идеального газа.
—средняя квадратичная энергия поступательного движения молекул идеального газа.
|
|
|
Давление идеального газа пропорционально средней кинетической энергии поступательного движения молекул и концентрации молекул.
Это давление тем больше, чем больше средняя кинетическая энергия поступательного движения молекул.
Средней квадратической скоростью называют величину, равную корню квадратному из среднего арифметического значения квадратов скоростей N молекул газа:

Дата добавления: 2022-01-22; просмотров: 35; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
