Металлические свойства — способность атомов отдавать электроны.
Именно наличием свободных электронов объясняются общие физические свойства металлов: высокая электропроводность и теплопроводность, характерный металлический блеск, ковкость.
Металлические свойства усиливаются в группах сверху вниз.
В каждой главной подгруппе наиболее выражены металлические свойства у элементов седьмого периода.
В периодах происходит ослабление металлических свойств.
В каждом периоде самые сильные металлические свойства у элементов IA группы, то есть у щелочных металлов.
В периодах металлические свойства ослабевают, а в группах — усиливаются.
Самый сильный металл — франций.

20.Полные и не полные электронные аналоги
Электронные аналоги - это элементы, у которых электронной расположены на орбиталях, описываемых общей для элементов формулой.
Полные электронные аналоги - элементы одной и той же подгруппы
Неполные электронные аналоги - элементы одной группы и побочной подгрупп.

21.Метод валентных связей
В основе метода валентных связей (ВС) лежат следующие положения:
- электронное строение химических соединений рассматривается как совокупность отдельных двухцентровых двухэлектронных химических связей, локализованных между соседними атомами;
- каждая индивидуальная химическая связь между двумя соседними атомами образуется в результате обобществления электронной пары с противоположно направленными спинами. Такая общая электронная пара может образовываться как в результате взаимодействия двух атомов, каждый из которых характеризуется наличием неспаренного электрона на перекрывающихся валентных орбиталях, (обменный механизм), так и за счет пары электронов одного атома – донора - и свободной орбитали другого атома – акцептора (донорно-акцепторный механизм);
|
|
|
- в зависимости от симметрии распределения электронной плотности общей электронной пары по отношению к линии химической связи между взаимодействующими атомами различают s, p и d связи. Поскольку между двумя атомами возможно образование не более одной s, двух p и одной d связи, то химические связи могут быть: одно- (s), двух- (s+p), трех- (s+2p) и четырехкратными (s+2p+d);
- так как энергия (Е) индивидуальной двухцентровой двухэлектронной химической связи тем больше, чем больше перекрывание между атомными орбиталями взаимодействующих атомов, то связь образуется в направлении максимального перекрывания и характеризуется направленностью в пространстве. В связи с различием в эффективности перекрывания атомных орбиталей: Е(s)> E(p)> E(d);
|
|
|
- количественная мера способности атома химического элемента к образованию химических связей – валентность - определяется числом двухэлектронных двухцентровых химических связей, образуемых атомом химического элемента со своими партнерами в химическом соединении. Учитывая обменный и донорно-акцепторный механизмы образования химических связей, валентность атома в химическом соединении приравнивается числу его использованных в связывании валентных орбиталей независимо от их заселенности электронами. Максимально возможная валентность атома химического элемента не может превышать число его валентных орбиталей, что определяет насыщаемость ковалентных химических связей.
22.Ковалентный тип связи, свойства. Механизм образования.
Ковалентная связь - это связь между атомами за счёт образования общих связывающих электронных пар.
При образовании ковалентной связи происходит перекрывание атомных орбиталей.
Ковалентная неполярная связь - этр связь, которая образуется за счёт общих электронных пар между атомами двух одинаковых неметаллов. (не отличаются по электроотрицательности)
Ковалентная полярная связь - связь между атомами элементов, электроотрицательности которых различаются
Свойства ковалентной связи :
Длина связи-межъядерное расстояние (нм)
Энергия связи - количество энергии, которое необходимо для разрыва связи (кДж/моль)
Насыщенность - способность атомов образовывать ограниченное число ковалентных связей.
Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию.
Механизмы образования ковалентной связи:
Обменный механизм - каждый атом предоставляет по одному неспаренному электрону для образования общей электронной пары.
2. Донорно-акцепторный механизм
Связь образуется за счёт двухэлектронного облака одного атома (неподеленной е пары) и свободной орбитали другого
Атом, дающий е пару для образования связи - донор, а атом, представляющий свободную орбиталь – акцептор
|
|
|

23.Ионный тип связи. Электроотрицательность, степень окисления
Ионная связь - это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Свойства ионной связи :
Ненасыщенность (число ионов, связанных ею, не ограничено)
Ненаправленность (направление присоединения ионов любое)
Особенности ионной связи:
1. Соединения в твёрдом состоянии образуют кристаллы
2. Соединения обладают высокой температурой плавления и кипения
3. Обладают электропроводностью в растворах и расплавах
|
|
|
Для определения типа связи используют значения относительной электроотрицательности (ОЭО)
• ΔОЭО ˂ 0,5 связь ковалентная неполярная
• 1,5 ≥ ΔОЭО ˃0,5 - ковалентная полярная
• ΔОЭО ˃ 1,5 – ионная
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.

24.Теория электролитической диссоциации. Классы неорганических соединений с позиции ТЭД.
В 1887 г. Шведский ученый С. Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации.
ТЭД Аррениуса (1887г.)
1. Молекулы электролитов при растворении или расплавлении диссоциируются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы - группы атомов, имеющие положительный или отрицательный заряд.
2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы к положительно заряженному электроду (аноду). Поэтому положительно заряженные ионы называются катионами, а отрицательно заряженные анионами
3. Диссоциация процесс обратимый. Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (т.к. растворы электролитов электронейтральны) 
25.Степень диссоциации электролитов. Константа диссоциации
Степень электролитической диссоциации- величина, которая показывает отношение числа распавшихся молекул n к общему числу растворенных молекул N
Степень электролитической диссоциации зависит
-от концентрации электролита (с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается)
-от температуры (увеличивается с повышении температуры)
-от электрических свойств растворителя


26.Ионное равновесие воды. Водородный показатель

27.Гидролиз солей. Типичные случаи гидролиза
Гидролиз солей - разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (водных) растворимых солей-электролитов.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде.
Различают обратимый и необратимый гидролиз солей.
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону)
3. Гидролиз соли слабой кислоты и слабого основания (необратимый)
Соль сильной кислоты и сильного основания не подвергается гидролизу




28.Окисление, восстановление. Окислители, восстановители.


29.Порядок уравнивания ОВР 

30. Виды ОВР

31.Комплексные соединения. Координационная теория Вернера.
Комплексные соединение - соединения высшего порядка, в состав которых входят комплексные частицы, способные к самостоятельному существованию и характеризуются наличием хотябы одной ковалентной связи, возникающий по донорно-акцепторному механизму.
Комплексообразование объясняет координационная теория А. Вернера, предложенная в 1893 г. И развитая в 1906 г. Л. Чугаевым.
Комплексные соединения образуются из двух или трех сложных веществ, часто из солей.
Координационная теория Вернера
1. Центральным атомом комплексной частицы является комплексообразователь. В качестве комплексообразователей обычно выступают d-элементы.
2. Вокруг комплексообразователя расположены (координированы) лиганды.
Лиганды - атомы или группа атомов, связанные с другим атомом (акцептором) с помощью донорно-акцепторного взаимодействия.
3. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения (обозначают [ ])
4. Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу (щелочные, щелочно-земельные металлы, кислотные остатки)
5. Число, показывающее, сколько лигандов удерживает комплексообразователь, называют координационным числом (к.ч.)
32.Механизм образования комплексных соединений
• Взаимодействие между комплексным ионом (внутренней сферой) и ионом внешней сферы осуществляется по ионному типу связи (диссоциирует как сильный электролит)
• Взаимодействие между комплексообразователем и лигандами осуществляется по донорно-акцепторному механизму за счет пары ē, поставляемых лигандами (лиганды – донор ē, комплексообразователь – акцептор)

33.Диссоциация комплексных соединений.

Первичная диссоциация
Комплексные соединения диссоциируют как сильные электролиты на комплексный ион (внутреннюю сферу) и ионы внешней среды
Вторичная диссоциация
Комплексные ионы диссоциируют как слабые электролиты, и можно применить ЗДМ
34.Классификация комплексных соединений.



35.Виды и основные стадии химического анализа
- качественный анализ служит для определения качественного химического состава и идентификации (установление идентичности с эталоном) веществ; - количественный анализ служит для определения количественных соотношений между компонентами химической системы
- элементный анализ – это установление наличия и количественного содержания химических элементов в веществе, то есть нахождение его элементного состава;
- функциональный анализ – это установление наличия и количественного содержания функциональных групп в молекулах органических соединений;
- молекулярный анализ – это установление наличия и количественного содержания молекул индивидуальных химических соединений в веществе, смесях и материалах;
- фазовый анализ – это анализ вещества на наличие в нем отдельных фаз, различающихся по своим химическим и физическим свойствам и отделенных друг от друга поверхностями раздела.
 Основные этапы химического анализа
Основные этапы химического анализа
1.Пробоотбор - процедура отбора, консервации, траспортировки и хранения порции вещества, предназначенной для анализа.
Виды проб а) Первичная (генеральная) проба отбирается на первом этапе от большой массы материала. Масса пробы может быть до 100 кг и более. Ее главным свойством является представительность (соответствие состава пробы среднему составу анализируемого образца). Первичная проба проходит измельчение (дробление, растирание) и перемешивание. б) Лабораторная (паспортная) проба получается путем сокращения первичной пробы до массы, необходимой для выполнения анализов (1–2 кг). Проба шифруется и хранится в ОТК до полного расходования партии материала. в) Аналитическая проба отбирается от лабораторной для проведения анализа путем взятия точной навески на аналитических весах. Масса пробы обычно до 1 г. РЕПОЗИТОРИЙ БГПУ Основные этапы химического анализа 2. Пробоподготовка — совокупность действий над объектом анализа с целью превращения пробы в подходящую для последующего анализа форму, а также для концентрирования/разбавления аналита и избавления от мешающих анализу компонентов. Основная задача пробоподготовки — подготовка вещества для определнного вида анализа В каком агрегатном состоянии должна быть проба для анализа? Нужно ли отделение мешающих компонентов? Необходимо ли концентрирование/разбавление? Нужно ли перевести анализируемый компонент в определенную форму? 3.Методы разделения и концентрирования: дистилляция, выпаривание, осаждение, экстракция, сорбция, хроматография РЕПОЗИТОРИЙ БГПУ Основные этапы химического анализа 4. Проведение химического анализа Титриметрические (волюметрические) методы - измерение объема раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом. Гравиметрические методы - измерение массы определяемого компонента, выделенного в виде веществ определённого состава. Электроаналитические методы - основаны на электрохимических явлениях, происходящих в исследуемой среде или на границе раздела фаз. Спектральные методы - основаны на взаимодействии анализируемого вещества с электромагнитным излучением. Методы разделения основаны на разделении с последующим определением (хроматография, электрофорез) Прочие методы 5. Обработка полученных результатов анализа, используя методы математической статистики
36.Основные понятия аналитической химии: аналитическая реакция, аналитический сигнал, селективные и специфические реакции. Чувствительность реакций
Аналитический сигнал (или признак) – изменение свойств анализируемой системы, которое человек может зафиксировать с помощью органов чувств или инструментально. Это может быть образование осадка, изменение окраски раствора, появление характерных линий в спектре, выделение газа, имеющего определённый запах, изменение электропроводности, величины окислительно-восстановительного потенциала и т. п.
Для получения аналитического сигнала проводят аналитические реакции – химические превращения анализируемого вещества, которые происходят при добавлении аналитического реагента с образованием продуктов реакции с заметными аналитическими признаками.
В качестве аналитических реакций чаще всего используют реакции с образованием окрашенных соединений, с выпадением или растворением осадка, с выделением газа с характерным запахом, с образованием кристаллов определённой формы, с возникновением люминесценции в растворе и т. п.
Избирательность, или селективность – следующая важная характеристика аналитической реакции. От этой характеристика зависит, много ли других веществ будут мешать обнаружению и определению искомого вещества.
В зависимости от этой характеристики различают специфические и избирательные реакции. Специфические реакции позволяют в определённых условиях обнаружить только одно вещество. При этом другие вещества, присутствующие в пробе, мешать не будут. Таких реакций очень немного.
Избирательные реакции позволяют обнаружить небольшое число веществ. Повысить избирательность, то есть уменьшить количество одновременно обнаруживаемых веществ можно изменением кислотности среды, концентрации реагентов, добавлением маскирующих агентов, изменением степени окисления элементов, охлаждением или нагреванием.
Чувствительность реакции связана с пределом обнаружения. Чем ниже предел обнаружения, тем выше чувствительность аналитической
реакции.
37.Погрешности и ошибки в химическом анализе.
Погрешности хим. Анализа – отклонение результата измерения от действительного значения измеряемой величины

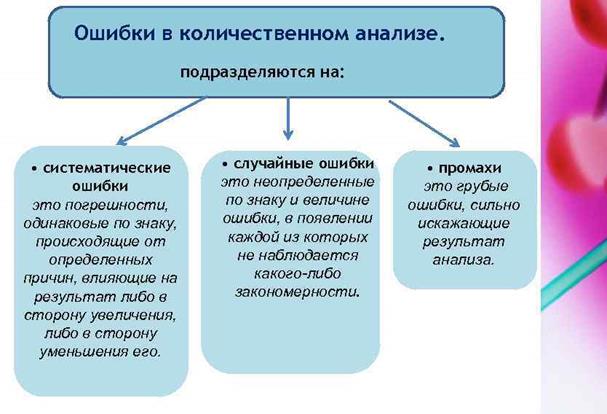
38.Классификация катионов по кислотно-основному методу.

39.Количественный анализ: классификация методов

40.Гравиметрический анализ. Классификация метода
Гравиметрический анализ (гравиметрия, весовой анализ) — метод количественного химического анализа, основанный на точном измерении массы вещества. Использует закон сохранения массы веществ при химических превращениях
Методы гравиметрии
1. Метод отгонки
а) метод прямой отгонки: определяемый компонент выделяют из пробы в виде газообразного продукта, улавливают и взвешивают
б) метод косвенной отгонки: массу газообразного продукта определяют по разности анализируемой пробы до и после термической обработки
2. Метод выделения
Основан на выделении определяемого компонента в свободном состоянии из анализируемого вещества и точном его взвешивании
В основе метода выделения лежит процесс экстракции
Экстракция – извлечение вещества с помощью растворителя, основанное на различном распределении вещества между несмешивающимися жидкостями
3. Метод осаждения
основан на осаждении определяемого компонента
Последовательность операций в методе осаждения:
1.Расчет массы навески.
В зависимости от количества образующегося осадка
2. Осаждение исследуемого вещества
41.Осаждаемая и весовая форма. Расчет гравиметрического фактора
Осаждаемая форма - соединение, которое образуется при взаимодействии с осадителем
Гравиметрическая (весовая) форма – соединение, которое взвешивают для получения окончательного результата
Требования к осаждаемой форме
1. Осадок должен быть практически нерастворимым.
2. Осадок должен выделяться в форме, удобной для его отделения от раствора.
3. Осадок должен легко превращаться в гравиметрическую форму.
Требования к весовой форме
1.Должна иметь точную химическую формулу.
2. Не должна при нагревании разлагаться и улетучиваться.
3.Должна быть химически устойчивой и негигроскопичной.
4.Гравиметрический фактор ее должен быть минимальным
ГФ и ОФ могут быть как одинаковыми, так и разными по химическому составу.

42.Метод осаждения. Последовательность аналитических операций.


43.Расчет массовой доли определяемого компонента, массы навески, объема осадителя в методе осаждения.


Определение объема осадителя
Для этого необходимо определить тип осадителя и умножить найденное теоретическое значение объема на коэффициент 1,5 – для нелетучих; и 2 – для летучих веществ. Пусть определяемое вещество А в ходе анализа нужно перевести в малорастворимое соединение  , используя осадитель В. Требуется рассчитать фактический объем осадителя, если задана его молярная концентрация
, используя осадитель В. Требуется рассчитать фактический объем осадителя, если задана его молярная концентрация  . Будем считать, что реакции осаждения определяемого компонента A осадителем B протекает по схеме:
. Будем считать, что реакции осаждения определяемого компонента A осадителем B протекает по схеме:
 где А – определяемый компонент; В – осадитель; p и q – стехиометрические коэффициенты.
где А – определяемый компонент; В – осадитель; p и q – стехиометрические коэффициенты.
Тогда масса осадителя может быть найдена из выражения:
 где m(B) – масса осадителя; m(A) – масса осаждаемого компонента в (г) и
где m(B) – масса осадителя; m(A) – масса осаждаемого компонента в (г) и 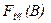 – фактор пересчета для осадителя, вычисляемый по формуле:
– фактор пересчета для осадителя, вычисляемый по формуле:
 где М(В) и М(А) – молярные массы осадителя и определяемого компонента соответственно.
где М(В) и М(А) – молярные массы осадителя и определяемого компонента соответственно.
Так как по условию задана молярная концентрация осадителя, то запишем ее формулу и выразим из нее теоретический объем


Преобразуем выражение , заменив массу осадителя на ее значение

Так как фактический расход осадителя определяется с учетом его летучести, то выполняют перерасчет найденного значения
 для нелетучих и солевых осадителей типа
для нелетучих и солевых осадителей типа  ,
, 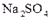 , NaOH
, NaOH
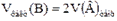 для летучих веществ, таких как
для летучих веществ, таких как 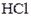 ,
, 
Расчет объема осадителя для других видов концентраций выполняется аналогично. Наиболее удобно в этом случае задавать концентрацию осадителя через простой титр.
44.Произведение растворимости. Условия образования и растворения осадков.



45.Понятия о стандартных веществах
Стандартным веществом называется реагент, используемый для стандартизации раствора титранта. Стандартные вещества бывают первичными и вторичными. Первичным стандартным веществом называется вещество высокой степени очистки, используемое для стандартизации титранта либо для приготовления первичного стандартного раствора, который в дальнейшем будет выступать в роли самостоятельного титранта. Например, гидрофталат калия используется в качестве стандартного вещества для стандартизации растворов щелочей, применяемых как титранты в кислотно-основном титровании. Как самостоятельный титрант это вещество не используют. Дихромат калия находит применение как самостоятельно (титрант), так и для стандартизации раствора тиосульфата натрия.
В качестве первичных стандартных веществ используют соединения, состав которых строго соответствует химической формуле. Эти вещества должны выпускаться промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаться очистке. Они также должны быть устойчивыми при обычных условиях. Желательно, чтобы такое вещество было безводным и нелетучим (хотя можно использовать и кристаллогидраты, если они устойчивы). Молярная масса такого вещества должна быть как можно больше (меньше будет погрешность при измерении массы навески).
Вторичным стандартным веществом называют растворы веществ, способных реагировать с титрантом, концентрация растворенного вещества в которых установлена с помощью первичного стандартного вещества. Например, раствор NaOH, который был стандартизирован при помощи гидрофталата калия, может быть сам использован для стандартизации раствора кислоты.
Растворы титрантов можно готовить также из фиксаналов. Фиксаналом (стандарт-титром) называются приготовленные и расфасованные в промышленных условиях (обычно в стеклянные ампулы) порции вещества, содержащие точно известное его количество (чаще всего 0,1 моль). Содержимое фиксанала растворяют в определенном объеме растворителя (обычно объем раствора составляет 1 л) и получают раствор, концентрация растворенного вещества в котором известна более или менее точно (растворы титрантов, приготовленные из фиксаналов, следует подвергать стандартизации).
46.Что такое титрование? Виды титриметрических определений: прямое, обратное, косвенное. Техника титрования.
Титрование (титриметрия) - процесс последовательного прибавления небольших порций раствора с известной концентрацией к измеренному объёму раствора с неизвестной концентрацией.
Цель: определение концентрации исследуемого раствора
Прямое титрование– к раствору определяемого вещества добавляют по каплям титрант до достижения точки эквивалентности.
Схема титрования: X + R = P.
Закон эквивалентов для прямого титрования:
C(1/z) Х VХ = C(1/z) RVR (2)
Количество (массу) определяемого вещества, содержащееся в исследуемом растворе, вычисляют, используя закон эквивалентов (для прямого титрования)
mХ= C(1/z)R VR M(1/z)Х ٠10-3 , (3)
где C(1/z)R – молярная концентрация эквивалента титранта, моль/дм3;
VR – объем титранта, см3;
M(1/z) Х – молярная масса эквивалента определяемого вещества;
C(1/z)Х – молярная концентрация эквивалента определяемого вещества, моль/дм3;
VХ – объем определяемого вещества, см3.
Обратное титрование– используют два титранта. Сначала
к анализируемому раствору добавляют точный объем первого титранта (R1), взятый в избытке. Остаток непрореагировавшего титранта R1 оттитровывают вторым титрантом (R2). Количество титранта R1, израсходованного
на взаимодействие с анализируемым веществом (Х) определяют по разности между добавленным объемом титранта R1 (V1) и объемом титранта R2 (V2) затраченного на титрование остатка титранта R1.
Схема титрования: X + R1фиксированный избыток = P1 (R1остаток).
R1остаток + R2 = P2.
При использовании обратного титрования закон эквивалентов записывается следующим образом:
 (4)
(4)
Массу определяемого вещества в случае обратного титрования вычисляют по формуле
 (5)
(5)
Способ обратного титрования применяется в тех случаях, когда для прямой реакции невозможно подобрать подходящий индикатор или она протекает с кинетическими затруднениями (низкая скорость химической реакции).
Титрование по замещению (косвенное титрование) – применяют в тех случаях, когда прямое или обратное титрование определяемого вещества невозможно или вызывает затруднения либо отсутствует подходящий индикатор.
К определяемому веществу Х добавляют какой-либо реагент А в избытке, при взаимодействии с которым выделяется эквивалентное количество вещества Р. Затем продукт реакции Р оттитровывают подходящим титрантом R.
Схема титрования: X + Аизбыток = P1.
P1 + R = P2.
Закон эквивалентов для титрования по замещению записывают следующим образом:
 (6)
(6)
Так как число эквивалентов определяемого вещества Х и продукта реакции Р одинаковы, расчет массы определяемого вещества в случае косвенного титрования вычисляют по формуле
mХ= C(1/z) R VR M(1/z) Х٠10-3. (7)




47.Титриметрические методы анализа, требования к реакциям. Классификация.
Титриметрический метод анализа основан на измерении объема реагента точно известной концентрации (титранта), затраченного на химическую реакцию с определяемым веществом. Процедура определения (титрование) состоит в том, что к точно известному объему раствора определяемого вещества с неизвестной концентрацией из бюретки по каплям добавляют титрант, до наступления точки эквивалентности.


48.Закон эквивалентов для реагирующих веществ.

49.Кислотно-основное титрование. Кривые титрования. Точка эквивалентности. Выбор индикатора. Что такое интервал перехода индикатора?
Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации: 
Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта. Построение кривых проводится в инструментальных методах аналитической химии, где отсутствует возможность визуального определения точки эквивалентности (например, по индикатору). Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования
Точка эквивалентности - это конец реакции, когда количество прибавленного раствора титранта эквивалентно количеству определяемого вещества.
Точка эквивалентности определяется :
По изменению окраски самого определяемого вещества в растворе
По выпадению осадка
По изменению правильно выбранного индикатора.

Интервалом перехода индикатора называется область значений pH, в которой становится видимым изменение цвета индикатора.
50.Окислительно-восстановительное титрование. Классификация методов по типу титрантов


51.Перманганатометрия. Сущность метода. Титрант, его приготовление, хранение, стандартизация. Фиксирование точки эквивалентности.
Перманганатометрия — это титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления с участием перманганат-ионов.
В перманганатометрии стандартным раствором является КМnО4. Сущность метода заключается в окислении восстановителей раствором перманганата калия. Окисление перманганатом калия можно проводить в кислой, нейтральной и щелочной среде. Но практически окисление проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства.


52.Комплексонометрия. Важнейшие комплексы в химическом анализе. Трилонометрия
53.Жесткость воды, ее виды. Методы устранения (привести уравнения соответствующих реакций).
Жесткость воды — это концентрация растворённых в ней солей магния (Mg) и кальция (Ca): гидрокарбонатов, хлоридов и сульфатов


54.Осадительное титрование. Общая характеристика метода. Аргентометрия. Стандартный раствор. Определение точки эквивалентности. Метод мора.
Метод осадительного титрования основан на применении реакций осаждения, в результате которых образуются малорастворимые соединения. Метод осадительного титрования даёт возможность количественно определять анионы, осаждаемые катионами металлов и катионы, если титровать их анионами.
 Аргентометрия — титриметрический метод количественного анализа анионов, образующих малорастворимые соединения или устойчивые комплексы с катионами серебра. Методы аргентометрии, главным образом, применяют для определения галогенидов, например, хлорида:
Аргентометрия — титриметрический метод количественного анализа анионов, образующих малорастворимые соединения или устойчивые комплексы с катионами серебра. Методы аргентометрии, главным образом, применяют для определения галогенидов, например, хлорида: 
Аргентометрия - метод осадительного титрования, который базируется на реакциях образования трудно растворимых солей Аргентума: X- + Ag+ = AgХ, где X- = Cl-, Br-, I-, CN-, SCN- и др. Титрант: AgNO3 - вторичный стандартный раствор.
Точка эквивалентности – это точка на кривой титрования, в которой количество определяемого вещества эквивалентно количеству титранта.


Метод Мора находит широкое применение при анализе пищевых продуктов. Количество поваренной соли в колбасе, соленой рыбе, масле и других продуктах определяют по методу Мора. Этот метод применяется также для определения хлоридов в воде.
Дата добавления: 2022-01-22; просмотров: 37; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
