Марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Растворы. Классификация растворов. Растворимость.
2. Способы выражения концентрации растворов.
3. Расчет молярной массы эквивалента.
4. Энтальпия процесса. Закон Гесса.
5. Энтропия процесса.
6. Энергия Гиббса.
7. Обратимые и необратимые реакции.
8. Принцип Ле-Шателье. Факторы, влияющие на смещение химического равновесия.
9. Понятие скорости химической реакции. Факторы, влияющие на скорость химической реакции.
10. Закон действия масс для гомогенной и гетерогенной реакции.
11. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа
12. Катализ и катализаторы.
13. Константа химического равновесия.
14. Строение атома. Квантовые числа.
15. Принцип и запрет Паули.
16. Правило Хунда.
17. Правило Клечковского, получение энергетического ряда Клечковского.
18. Периодический закон. Периодическая система Д.И. Менделеева.
19. Потенциал ионизации. Сродство к электрону. Металлические свойства. Изменение по группам и периодам.
20. Полные и не полные электронные аналоги.
21. Метод валентных связей.
22. Ковалентный тип связи, свойства. Механизм образования.
23. Ионный тип связи. Электроотрицательность, степень окисления.
24. Теория электролитической диссоциации. Классы неорганических соединений с позиции ТЭД.
25. Степень диссоциации электролитов. Константа диссоциации.
26. Ионное равновесие воды. Водородный показатель.
27. Гидролиз солей. Типичные случаи гидролиза.
|
|
|
28. Окисление, восстановление. Окислители, восстановители.
29. Порядок уравнивания ОВР.
30. Виды ОВР.
31. Комплексные соединения. Координационная теория Вернера.
32. Механизм образования комплексных соединений.
33. Диссоциация комплексных соединений.
34. Классификация комплексных соединений.
35. Виды и основные стадии химического анализа
36. Основные понятия аналитической химии: аналитическая реакция, аналитический сигнал, селективные и специфические реакции. Чувствительность реакций.
37. Погрешности и ошибки в химическом анализе.
38. Классификация катионов по кислотно-основному методу.
39. Количественный анализ: классификация методов.
40. Гравиметрический анализ. Классификация метода.
41. Осаждаемая и весовая форма. Расчет гравиметрического фактора.
42. Метод осаждения. Последовательность аналитических операций.
43. Расчет массовой доли определяемого компонента, массы навески, объема осадителя в методе осаждения.
44. Произведение растворимости. Условия образования и растворения осадков.
45. Понятия о стандартных веществах.
46. Что такое титрование? Виды титриметрических определений: прямое, обратное, косвенное. Техника титрования.
47. Титриметрические методы анализа, требования к реакциям. Классификация.
|
|
|
48. Закон эквивалентов для реагирующих веществ.
49. Кислотно-основное титрование. Кривые титрования. Точка эквивалентности. Выбор индикатора. Что такое интервал перехода индикатора?
50. Окислительно-восстановительное титрование. Классификация методов по типу титрантов.
51. Перманганатометрия. Сущность метода. Титрант, его приготовление, хранение, стандартизация. Фиксирование точки эквивалентности.
52. Комплексонометрия. Важнейшие комплексы в химическом анализе. Трилонометрия.
53. Жесткость воды, ее виды. Методы устранения (привести уравнения соответствующих реакций).
54. Осадительное титрование. Общая характеристика метода. Аргентометрия. Стандартный раствор. Определение точки эквивалентности. Метод мора.
Растворы. Классификация растворов. Растворимость.
Раствор — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределен в массе другого в виде своих частиц, то есть атомов, молекул или ионов.
1. По характеру растворителя:
1) водные;
2) неводные: растворы в органических растворителях (спирты, эфиры, ацетон, бензол).
|
|
|
2. По точности выражения концентрации: приблизительные, точные и эмпирические.
3. По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные.
4. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества; концентрированные растворы - с большим содержанием растворенного вещества.
5. По агрегатному состоянию растворителя: растворение твёрдых веществ, жидкостей и газов.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твёрдыми растворами являются многие сплавы, например, металлов друг с другом, стёкла.
При растворении веществ образуются насыщенные и ненасыщенные растворы. Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре. Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре. Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
|
|
|
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается. Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
Существует несколько классов веществ и соединений: растворимые малорастворимые; нерастворимые.
2.Способы выражения концентрации растворов.
 Процентная концентрация, или массовая доля вещества, выражается числом граммов растворенного вещества, содержащихся в 100 г раствора
Процентная концентрация, или массовая доля вещества, выражается числом граммов растворенного вещества, содержащихся в 100 г раствора
Молярная концентрация выражается числом молей растворенного вещества, содержащихся в 1 л раствора
Молярная концентрация эквивалентов, или нормальная концентрация, выражается числом моль-эквивалентов растворенного вещества в 1л раствора
Моляльная концентрация выражается числом молей растворенного вещества, содержащихся в 1 кг растворителя
Титр – масса растворенного вещества в 1 мл раствора
3.Расчет молярной массы эквивалента.
Молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода, или количеству электронов 1 моль.
Молярная масса эквивалентов кислоты:

Молярная масса эквивалентов основания:

Молярная масса эквивалентов соли:

4.Энтальпия процесса. Закон Гесса
Энтальпия – это функция состояния термодинамической системы, характеризующая ее теплосодержание.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее изменение (ΔН) обычно относят к 1 моль вещества и выражают в килоджоулях на моль. Для любой химической реакции тепловой 12 эффект равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении этой реакции (стандартные теплоты образования различных веществ приводятся в термодинамических справочниках), при этом условно принято, что теплоты образования простых веществ равны нулю:

Закон Гесса
Тепловой эффект реакции не зависит от пути процесса, а определяется только начальным и конечным состояниями системы.

5.Энтропия процесса
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Для расчета ∆S любой реакции надо из суммы энтропий образования продуктов вычесть сумму энтропий образования исходных веществ (с учетом стехиометрических коэффициентов). Так, для стандартных условий:

Второй закон термодинамики: в изолированной системе самопроизвольно идут только те процессы, которые сопровождаются возрастанием энтропии (ΔS>0). Если процесс протекает так, что ΔН = 0 (изолированная система), то изменение энтропии становится его единственной движущей силой. Причем чем выше температура, тем сильнее проявляется энтропийный фактор (ТΔS). При условии ΔS = 0 единственной движущей силой химической реакции является убыль энтальпии − энтальпийный фактор ΔН.
6.Энергия Гиббса
При неравенстве энтальпии и энропии их разность может служить мерой химического сродства реагентов: ΔG = ΔH − TΔS, где T – абсолютная температура в кельвинах. Она носит название энергии Гиббса (или изобарно изотермический потенциал). При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG <0)
Изобарно-изотермический потенциал реакции рассчитывается:
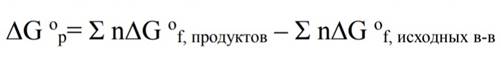
Если ΔG <0, то прямая реакция может протекать самопроизвольно. Если ΔG=0, то ΔH=TΔS, система находится в состоянии истинного химического равновесия. Если ΔG>0, то самопроизвольно может протекать обратная реакция.
7.Обратимые и необратимые реакции
Все химические реакции делятся на два типа: обратимые и необратимые.
Необратимыми называются реакции, которые протекают только в одном направлении, т. е. продукты этих реакций не взаимодействуют друг с другом с образованием исходных веществ.
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др., например,
C2H5OH + 3O2 → 2CO2 + 3H2O
Обратимыми называются реакции, которые одновременно протекают в прямом и в обратном направлениях:

В уравнениях обратимых реакций используется знак обратимости. 
Примером обратимой реакции является синтез йодоводорода из водорода и йода: 
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечный продукт реакции НI, но и исходные вещества —H2 и I2. Как бы долго ни продолжалась реакция, в реакционной смеси при 350oС всегда будет содержаться приблизительно 80% HI,10% Н2 и 10% I2. Если в качестве исходного вещества взять НI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осуществляются прямая и обратная реакции.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
8.Принцип Ле-Шателье. Факторы, влияющие на смещение химического равновесия.
Если на систему, которая находится в состоянии динамического равновесия, оказывать внешнее воздействие, то в системе будут протекать процессы, направленные на уменьшение этого внешнего воздействия. Так, например, если:
· а) повышать температуру, то равновесие сместится в сторону эндотермической реакции;
· б) понижать температуру, то равновесие сместится в сторону экзотермической реакции;
· в) повышать давление - равновесие сместится в сторону образования меньшего числа молекул;
· г) понижать давление — равновесие сместится в сторону образования большего числа молекул;
· д) увеличивать концентрацию исходных веществ — равновесие сместится в сторону образования продуктов реакции;
· е) увеличивать концентрацию продуктов реакции — равновесие сместится в сторону образования исходных веществ.

9.Понятие скорости химической реакции. Факторы, влияющие на скорость химической реакции.
Раздел химии, который изучает скорость и механизмы протекания химических реакций — химическая кинетика.
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени.

10.Закон действия масс для гомогенной и гетерогенной реакции.
В 1867 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали закон действующих масс (ЗДМ): скорость химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Закон действующих масс для гомогенных реакций (то есть протекающих в пределах одной фазы) – Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций, реагирующий веществ, возведенных в степени, численно равным их стехиометрическим коэффициентам: NH3 + HCl ⇒ NH4Cl V = k2 [NH3][HCl] Hb(aq) + O2(aq) ⇒ HbO2(aq) V = k ×[Hb]×[O2]
Применение Закона действующих масс к гетерогенным реакциям имеет свою особенность: концентрация твердой фазы не входит в кинетическое уравнение скорости, так как реакция протекает на поверхности раздела фаз и скорость реакции зависит от степени измельчения твердой фазы. Например,: Zn(гранулы) + 2HClраствор → H2↑+ ZnCl2 V1 = k1×[HCl]2 порядок реакции = 2 Zn(порошок) + 2HClраствор → H2↑+ ZnCl2 V2 = k2 ×[[HCl]2 порядок реакции = 2 Понятно, что V2 >V1, а так как концентрация соляной кислоты в первом и втором случае одинакова, следовательно, k2 > k1. Таким образом, именно 5 константа скорости гетерогенной реакции зависит от размера реагирующих частиц (то есть от площади поверхности твердого вещества).
11.Влияние температуры на скорость химической реакции. Правило Вант-Гоффа
Скорость большинства реакций возрастает с повышением температуры.
По правилу Вант-Гоффа:
при повышении температуры на каждые 10 °С скорость большинства реакций увеличивается в 2–4 раза.

где гамма — температурный коэффициент, который показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10 °С.
Увеличение скорости реакции при повышении температуры связано не только с возрастанием кинетической энергии и количеством столкновений частиц реагирующих веществ.
Если бы все сталкивающиеся частицы реагировали друг с другом, реакция была бы подобна взрыву!
Но часть столкновений не приводит к образованию новых веществ.
Реакция происходит только в результате эффективных столкновений частиц, имеющих избыточную энергию — энергию активации.
Этой энергии достаточно для разрыва или ослабления связей, что может привести к перестройке атомов в новые молекулы.
При повышении температуры доля активных молекул возрастает; увеличивается количество эффективных столкновений. Таким образом, скорость химической реакции растёт.
12.Катализ и катализаторы
Катализ - изменение скорости химической реакции в присутствии катализаторов
Катализатор - вещество, участвующие в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается.
Катализ:
Гомогенный - Каталитические процессы, при протекании которых реагирующие вещества и катализатор образуют одну фазу. Различаю гомогенный катализ в газовой и жидкой фазе.
Коллоидные каталитические системы - Реагирующие вещества находятся в растворе, катализатор - большие полимерные молекулы.
Гетерогенный - Каталитическая система включает несколько фаз, реагирующие вещества и катализатор находятся в разных фазах.
Катализатор:
участвует в реакции, образуя интермедиаты с реагентами
в результате реакции не расходуется
изменяет путь реакции и тем самым влияет на энергию активации
не влияет на термодинамические характеристики катализируемой реакции (Энтальпию, энтропию, энергию Гиббса, константу равновесия)
Основные качества катализаторов: активность, селективность, устойчивость.
13.Константа химического равновесия
Химическое равновесие - состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой.

Константа равновесия - величина, определяющая сравнительную глубину протекания прямой и обратной реакции.
Константа равновесия (К) не зависит от концентрации веществ.
Константа зависит от температуры, увеличивается для эндотермических и уменьшается для эндотермических реакций.
14.Строение атома. Квантовые числа
Атом - мельчайшая химически неделимая электронейтральная частица вещества. Атом электронейтрален.
В центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны.
Виды элементарных частит: протоны (р), нейтроны (n), электроны (е).
Общее число протонов и нейтронов в ядре атома называют массовым числом A=N+P
Химический элемент - вид атомов с определенным зарядом ядра
Изотопы - разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядре, но разную массу
Квантовые числа описывают состояние электрона в атоме

15.Принцип и запрет Паули
Принцип исключения Паули утверждает, что два электрона (или два любых других фермиона) не могут иметь одинаковое квантово-механическое состояние в одном атоме или одной молекуле. Другими словами, ни одна пара электронов в атоме не может иметь одинаковые электронные квантовые числа.
 Этот принцип был предложен австрийским физиком Вольфгангом Паули в 1925 году для описания поведения электронов.
Этот принцип был предложен австрийским физиком Вольфгангом Паули в 1925 году для описания поведения электронов.
16.Правило Хунда.
С помощью правила Хунда (Гунда) определяется порядок заполнения орбиталей определенного подслоя. Формулировка правила звучит следующим образом: совокупное количество электронов данного подслоя должно быть максимальным.
То есть каждая орбиталь подслоя заполняется сначала одним электроном, и только после исчерпания незаполненных орбиталей на эту орбиталь примыкает 22-й электрон. Причем на 11-й орбитали находятся 22 электрона с полуцелыми спинами противоположного знака, которые вместе образуют двухэлектронное облако. В итоге суммарный спин орбитали равняется 00.
Есть и другая формулировка правила Хунда: ниже по энергии находится атомный терм, для которого соблюдаются 22 условия:
1. В случае совпадения мультиплетностей суммарный орбитальный момент L максимальный.
2. Максимальная мультиплетность;
Правило Хунда – это приближенное правило, определяющее относительное нахождение энергетических уровней атома. Открыто Ф. Хундом в 19271927-м году при анализе атомных спектров.
С правилами Хунда тесно переплетается важный для теории молекулярных орбиталей принцип заполнения: из нескольких конфигураций молекулы ниже по энергии те, для которых сумма значений орбитальных энергий атомов меньше.
Правило Хунда ограничено низко лежащими состояниями атомов с условием, что воздействие электронной корреляции (взаимной обусловленности движений электронов) небольшое и не нарушает границ применимости одно-конфигурационного приближения.
Основание для выполнения 11-го правила – это тесная взаимосвязь между симметрией пространственной части волновой функции атома и симметрией ее спиновой части, существующая по принципу Паули. Поэтому 11-е правило Хунда обычно осуществляется и для молекул.
Определение 5
22-е правило Хунда имеет более ограниченное применение и определяется, как правило, тем, насколько существенно межэлектронное отталкивание в анализируемых состояниях. Данное правило выполнимо иногда и для линейных молекул (при замене L на модуль проекции момента количества движения на ось молекулы).
17.Правило Клечковского, получение энергетического ряда Клечковского
(Принцип наименьшей энергии)
В атоме каждый электрон стремится занять положение, соответствующее минимальному значению энергии, что отвечает наибольшей связи с ядром. Последовательность заполнения энергетических уровней и подуровней в атоме электронами происходит в соответствии с принципом наименьшей энергии. Энергия электрона определяется в основном главным квантовым числом и побочным , поэтому сначала заполняются те подуровни, для которых сумма значений наименьшая. Если для двух подуровней суммы значений и одинаковы, то сначала идет заполнение подуровня с меньшим значением . Таким образом, заполнение энергетических уровней и подуровней происходит в следующей последовательности: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p

18.Периодический закон. Периодическая система Д.И. Менделеева.
1. Порядковый номер химического элемента - номер, данный элементу при его нумерации. Показывает общее число электронов в атоме и число протонов в ядре, определяет заряд ядра атома данного химического элемента.
2. Период – химические элементы, расположенные в строчку (периодов всего 7). Период определяет количество энергетических уровней в атоме.
Малые периоды (1 – 3) включают только s- и p- элементы (элементы главных подгрупп) и состоят из одной строчки; большие (4 – 7) включают не только s- и p- элементы (элементы главных подгрупп), но и d- и f- элементы (элементы побочных подгрупп) и состоят из двух строчек.
3. Группы – химические элементы, расположенные в столбик (групп всего 8). Группа определяет количество электронов внешнего уровня для элементов главных подгрупп, а так же число валентных электронов в атоме химического элемента.
Главная подгруппа (А) – включает элементы больших и малых периодов (только s- и p- элементы).
Побочная подгруппа (В) – включает элементы только больших периодов (только d- или f- элементы).
4. Относительная атомная масса ( Ar ) – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина (для расчётов берут округлённое значение).
5. Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой, с одинаковым порядковым номером.
марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Дата добавления: 2022-01-22; просмотров: 16; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
