Реакции электрофильного замещения
АРЕНЫ
Арены – это ароматические углеводороды, содержащие одно или несколько бензольных ядер.
Классификация и номенклатура
По числу бензольных ядер и способу их соединения различают:
- моноядерные арены (бензол и его гомологи)

- полиядерные арены с изолированными бензольными ядрами:

- полиядерные арены с конденсированными бензольными ядрами:
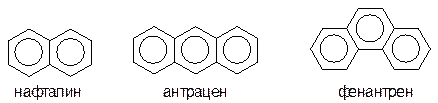
По номенклатуре IUPAC арены называют как производные бензола. Для многих соединений используют тривиальные названия. В незамещенном бензольном кольце все положения равноценны, поэтому монозамещенные производные не имеют изомеров положения. Дизамещенные бензолы существуют в виде трех структурных изомеров: орто- (1,2-), мета- (1,3-) и пара- (1,4-).
Методы получения
1)Дегидрирование шестичленных алициклических углеводородов.

2)Дегидроциклизация алканов.

Арены образуются из алканов, содержащие в цепи не менее шести атомов углерода.
3)Циклотримеризация алкинов.
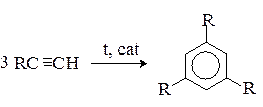
4) Реакция Вюрца-Фиттига
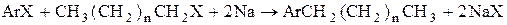
X= Cl, Br, I
Ar – ароматический радикал
5) Алкилирование бензола

X= Cl, Br, I
Физические свойства
Бензол и его гомологи являются бесцветными жидкостями или кристаллическими веществами со своеобразным запахом. Температуры кипения алкилбензолов закономерно возрастают с увеличением молекулярной массы. Температуры плавления сильно зависят от симметрии молекул. Так, некоторые высокосимметричные производные (бензол, п-ксилол) имеют аномально высокие температуры плавления. Например, введение метильной группы в высокосимметричную молекулу бензола понижает температуру плавления от +5,50С (бензол) до -950С (толуол).
|
|
|
Бензол и многие конденсированные арены токсичны, некоторые их них, например, бензопирен имеют канцерогенное действие.
Химические свойства
Химические свойства ароматических соединений определяются наличием системы делокализованных p-связей. Присутствие p-электронной системы обусловливает основные свойства аренов и их взаимодействие с электрофильными реагентами. Повышенная термодинамическая стабильность ароматического кольца делает предпочтительными реакции замещения, в которых ароматическая система сохраняется. Как следствие этого, наиболее характерными для ароматических соединений являются реакции электрофильного замещения. Известны также реакции радикального галогенирования и окисления боковых цепей алкилбензолов, которые протекают по наиболее реакционноспособному бензильному положению. Процессы, в которых разрушается стабильная ароматическая система, мало характерны и протекают в жестких условиях.
|
|
|
Реакции электрофильного замещения
Наиболее важные реакции этого типа представлены на схеме 8.1.
Схема 8.1. Основные превращения аренов

Механизм ароматического электрофильного замещения. Большинство реакций ароматического электрофильного замещения протекает по единому механизму  , который может быть представлен следующей схемой:
, который может быть представлен следующей схемой:

Реакция начинается с образования p-комплекса, в котором p-электронная система ароматического ядра выступает как донор электронов, а электрофильный реагент ( 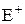 ) действует как акцептор. Далее p-комплекс с разрушением ароматической системы медленно перегруппировывается в s-комплекс, в котором электрофил связан s-связью с определенным атомом углерода цикла, а положительный заряд делокализован по сопряженной системе циклогексадиенильного катиона. На последней стадии происходит отщепление протона от s-комплекса под действием основания с восстановлением ароматической системы. Лимитирующей стадией в процессе электрофильного замещения является стадия образования s-комплекса.
) действует как акцептор. Далее p-комплекс с разрушением ароматической системы медленно перегруппировывается в s-комплекс, в котором электрофил связан s-связью с определенным атомом углерода цикла, а положительный заряд делокализован по сопряженной системе циклогексадиенильного катиона. На последней стадии происходит отщепление протона от s-комплекса под действием основания с восстановлением ароматической системы. Лимитирующей стадией в процессе электрофильного замещения является стадия образования s-комплекса.
Делокализация положительного заряда в s-комплексе происходит за счет орто- и пара-положений по отношению к вступающему заместителю, что может быть показано с помощью набора резонансных структур:
|
|
|

Ход реакции и ее механизм иллюстрирует энергетическая диаграмма, представленная на рисунке 8.1.

Рис.8.1. Энергетическая диаграмма процесса  .( Еа – энергии активации, Т – переходные состояния соответствующих стадий).
.( Еа – энергии активации, Т – переходные состояния соответствующих стадий).
Ориентация и реакционная способность. Если бензольное кольцо уже содержит заместитель, то:
1) реакция может протекать быстрее или медленнее, чем с самим бензолом;
2) возможно образование трех разных продуктов замещения:

Влияние заместителя в бензольном кольце можно объяснить исходя из его электронных эффектов. По этому признаку заместители можно разделить на 3 основных группы:
1. Заместители, ускоряющие реакцию по сравнению с незамещенным бензолом (активирующие) и направляющие замещение в орто,-пара- положения.
2. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в орто,-пара- положения.
3. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в мета- положения.
Заместители, отмеченные в п.п. 1,2 (орто-,пара-ориентанты) называются заместителями I-го рода; отмеченные в п.3 (мета-ориентанты) - заместителями II-го рода.
|
|
|
Таблица 8.1.Влияние заместителей на реакции 
| Ориентанты I-го рода (орто-, пара-) | Ориентанты II-го рода (мета-) | |
| активирующие | дезактивирующие | дезактивирующие |
Все алкильные группы, -OH, -OR, -O-, -OC(O)R,  , -NHR, , -NHR, 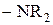 , NHC(O)R , NHC(O)R
| Галогены: F, Cl, Br, I | -CHO, -C(O)R, -CN,
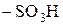 , -COOH,
-COOR, , -COOH,
-COOR, 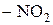 , ,
 , , 
|
К активирующим относятся электронодонорные заместители, которые за счет +I- или +М-эффекта повышают основность ароматического кольца. Дезактивирующее влияние оказывают электроноакцепторные заместители.
Ориентацию электрофильного замещения в бензольном кольце объясняют с точки зрения стабильности образующегося в качестве промежуточной частицы s-комплекса. При этом предполагают, что переходное состояние медленной стадии по структуре близко или идентично s-комплексу. Заместитель Z в молекуле  может стабилизировать или дестабилизировать этот интермедиат.
может стабилизировать или дестабилизировать этот интермедиат.
Для объяснения ориентации замещения рассмотрим строение s-комплексов при атаке в орто-, мета- и пара-положения монозамещенного бензола.

Если группа Z - донор электронов, то при орто- или пара-атаке она может принимать непосредственное участие в делокализации положительного заряда в s-комплексе за счет +М-эффекта (структуры IV, VII), что делает орто- и пара-s-комплексы более стабильными, чем s-комплекс, ведущий к продукту мета-замещения. Если же Z - акцептор электронов, то структуры III и IV будут энергетически невыгодными из-за наличия частичного положительного заряда на атоме углерода, связанном с электроноакцепторным заместителем, а реализация структур IV и VII невозможна. В этом случае более стабильным будет s-комплекс, ведущий к продукту мета-замещения, в котором нет таких структур.
Приведенное выше объяснение дано на основании так называемого динамического эффекта, т.е. распределения электронной плотности в реагирующей молекуле. Ориентацию электрофильного замещения в монозамещенных бензолах можно объяснить и с позиции статических электронных эффектов - распределения электронной плотности в нереагирующей молекуле. При рассмотрении смещения электронной плотности по кратным связям можно заметить, что при наличии электронодонорного заместителя более всего повышена электронная плотность в орто- и пара- положениях, а при наличии электроноакцепторного заместителя эти положения наиболее обеднены электронами:
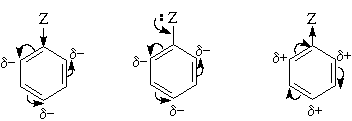
Особый случай представляют собой галогены - они дезактивируют бензольное ядро в реакциях электрофильного замещения, однако являются орто-, пара-ориентантами. Дезактивация связана с тем, что, в отличие от других группировок с неподеленными электронными парами (таких как -OH,  ), обладающих +М-эффектом и –I-эффектом, для галогенов характерно преобладание индуктивного эффекта над мезомерным (+М< -I).z:\CorvDoc\lektsiiorg11Святик\fn.html - 30
), обладающих +М-эффектом и –I-эффектом, для галогенов характерно преобладание индуктивного эффекта над мезомерным (+М< -I).z:\CorvDoc\lektsiiorg11Святик\fn.html - 30

В то же время, атомы галогенов являются орто,пара-ориентантами, поскольку способны за счет положительного мезомерного эффекта участвовать в делокализации положительного заряда в s-комплексе, образующемся при орто- или пара- атаке (структуры IV, VII в приведенной выше схеме), и тем самым снижают энергию его образования.
Если в бензольном ядре имеется не один, а два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация) или не совпадать (несогласованная ориентация). В первом случае можно рассчитывать на преимущественное образование каких-то определенных изомеров, а во втором будут получаться сложные смеси.z:\CorvDoc\lektsiiorg11Святик\fn.html - 31 Ниже приведены некоторые примеры согласованной ориентации двух заместителей; место преимущественного вступления третьего заместителя показано стрелкой.
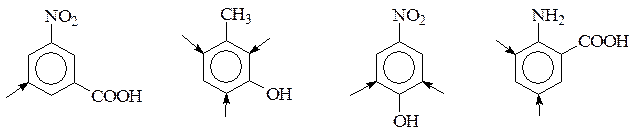
Дата добавления: 2022-01-22; просмотров: 20; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
