Раздел 2. Молекулярная физика и термодинамика
Глава 4. Кинетическая теория
§ 4.1. Тепловое движение
1. Вещество состоит из структурных элементов – атомов и молекул. Напомним, что массы атомов, измеренные в атомных единицах[5], указаны в таблице Менделеева. Массу молекулы вычисляют суммированием масс составляющих ее атомов. Эти массы называют относительной атомной, соответственно, относительной молекулярной массой. Даже микроскопическая с обыденной точки зрения масса вещества состоит из огромного числа частиц. Например, 1 см3 воздуха при обычных условиях имеет массу немного более 1 мг и содержит более 1019 частиц. В жидкостях и в твердых телах концентрация частиц еще больше, соответственно, больше плотность вещества. Макроскопическим считают тело, состоящее из такого числа частиц N, что ln N >>1[6].
Количество вещества принято измерять в молях. Моль – количество вещества, в котором содержится определенное число структурных единиц, оно называется числом (или постоянной) Авогадро: Na=6,02.10 23 моль -1. Массу моля вещества называют молярной массой, ее численное значение в граммах равно относительной молекулярной массе. Для вещества в атомарном состоянии молярная масса численно равна атомной массе. Обозначим молярную массу М, массу одной молекулы т0, тогда
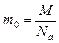 (4.1.1)
(4.1.1)
Совокупность частиц тела называют термодинамической системой. Термодинамической системой является любое макроскопическое тело: твердое, жидкое, газообразное.
|
|
|
2. Частицы (атомы и молекулы) вещества непрерывно хаотически движутся. Это движение называется тепловым. Именно оно определяет внутреннее состояние каждого тела и индивидуальные свойства вещества.
Фундаментальным свойством теплового движения является его «забывчивость». Поясним на примере. Капля окрашенной жидкости, попав в прозрачную воду, со временем равномерно распределится по всему объему. Окончательное состояние смеси будет одинаковым независимо от того, в каком месте в начальный момент появилась окрашенная капля - ее начальное состояние будет «забыто». Если внешние условия не изменяются, то равномерное распределение окрашенного вещества со временем меняться не будет. Не изменяющееся со временем состояние называется стационарным. В стационарном состоянии тела через его границы может переноситься не изменяющийся со временем поток вещества, энергии, импульса, электрического заряда. Например, при протекании тока по проводнику через его поперечное сечение происходит перенос заряда, а через поверхность проводника переносится энергия в виде количества тепла. Если через границы тела нет никаких потоков, то такое тело называется изолированной термодинамической системой. «Забывчивость» теплового движения приводит изолированную термодинамическую систему в состояние, которое называется тепловым или термодинамическим равновесием. В равновесном состоянии в любых участках системы характеристики одинаковы и неизменны.
|
|
|
Именно тепловое движение и его «забывчивость» являются причиной возникновения термодинамического равновесия.
3. Модель материального тела представляет собой систему огромного числа частиц. Каждая частица в зависимости от обстоятельств и рассматриваемого явления может быть представлена моделью классической, например, м.т. или а.т.т., или квантовой. Взаимодействие частиц друг с другом подчиняется известным законам (классическим или квантовым). Движение каждой отдельной частицы можно рассчитать, используя законы динамики. Действительно, зная начальное состояние всех частиц и законы их взаимодействия, можно для каждой из них составить и решить уравнение движения. Однако подумайте, какое громадное число уравнений надо решить и сколько для этого требуется времени, жизни не хватит! Если даже эти уравнения будут решены, то полученная из них информация окажется бесполезной: при термодинамическом равновесии состояние системы остается неизменным, тогда как состояние каждой частицы непрерывно изменяется в результате ее теплового движения. Это значит, что одному и тому же состоянию всей системы (его называют макросостоянием) соответствует множество разных состояний частиц системы (микросостояний).
|
|
|
Предметом изучения молекулярной физики и термодинамики являются свойства и поведение термодинамической системы как целого. Из сказанного ясно, что динамическое описание системы многих частиц неосуществимо с технической, непригодно с теоретической и бесполезно с практической точек зрения.
4. Для изучения свойств макротел (термодинамических систем) физика использует два метода: статистический и термодинамический.
Статистический метод основан на теории вероятностей и истолковывает свойства тел как суммарный, усредненный результат движения отдельных молекул. Статистический метод выявляет закономерности, которым подчиняется, казалось бы, полный беспорядок в движении отдельных молекул.
Термодинамический метод является феноменологическим[7]. Это означает, что он рассматривает тело «снаружи», не вдаваясь в его внутреннее строение, на основе небольшого числа фундаментальных законов (они называются началами термодинамики), полученных обобщением опыта. Термодинамический метод иногда называют энергетическим методом рассмотрения тел (первое начало термодинамики – закон сохранения энергии). Этот метод широко применяется при анализе различных физических систем и явлений, изучаемых в разных разделах физики.
|
|
|
Статистический и термодинамический методы взаимно дополняют друг друга, образуя, по сути, единое целое.
§ 4.2. Основное уравнение кинетической теории газа
1. Атомы и молекулы вещества на небольших по сравнению с их размерами расстояниях притягиваются друг к другу, причем, силы притяжения быстро уменьшаются при увеличении расстояния. В газах его частицы большую часть времени находятся так далеко друг от друга, что силы притяжения не в состоянии противодействовать разбрасывающему их тепловому движению. При сближении частиц на расстояния, соответствующие столкновению, силы притяжения частиц сменяются силами отталкивания, и частицы вновь разлетаются. Можно считать, что между столкновениями частицы движутся свободно, при этом время свободного движения значительно превосходит время столкновений, и газ вследствие теплового движения всегда полностью занимает предоставленный ему объем. Отсюда модель идеального газа:
· собственный объем молекул мал по сравнению с объемом газа (т.е.с объемом сосуда):
· потенциальная энергия взаимодействия молекул пренебрежимо мала по сравнению с кинетической энергией хаотического движения, так что можно считать, чтомежду двумя последовательными столкновениями частицы движутся свободно, т.е. равномерно и прямолинейно;
· вследствие хаотичности любые направления движения частиц равновероятны, т.е. в любом направлении в любой момент времени движется примерно одинаковое число частиц;
· соударения молекул друг с другом и со стенками сосуда упругие.
2. При столкновении со стенкой сосуда молекула сообщает ей импульс. Напомним, что переданный в единицу времени импульс равен силе, действующей на стенку, а сила, направленная перпендикулярно к поверхности, и отнесенная к единице площади поверхности, равна давлению: 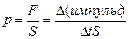 . Для простоты рассмотрим сосуд прямоугольной формы объемом V= Sl, где S – площадь боковой стенки, перпендикулярной оси х, l - длина ребра вдоль оси х (см. рис. 15). Одна из молекул (ее масса m0) летит вдоль оси х со скоростью υ из точки 1, в точке 2 упруго сталкивается со стенкой, сообщает ей импульс 2m0υ и отскакивает без потери скорости к противоположной стенке. Ударившись в точке 1, молекула опять движется в точку 2 и, спустя время
. Для простоты рассмотрим сосуд прямоугольной формы объемом V= Sl, где S – площадь боковой стенки, перпендикулярной оси х, l - длина ребра вдоль оси х (см. рис. 15). Одна из молекул (ее масса m0) летит вдоль оси х со скоростью υ из точки 1, в точке 2 упруго сталкивается со стенкой, сообщает ей импульс 2m0υ и отскакивает без потери скорости к противоположной стенке. Ударившись в точке 1, молекула опять движется в точку 2 и, спустя время 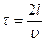 опять сообщит стенке такой же импульс. За единицу времени этот процесс произойдет 1/t раз, так что удары одной молекулы о стенку сосуда создадут силу m0υ 2/ l.
опять сообщит стенке такой же импульс. За единицу времени этот процесс произойдет 1/t раз, так что удары одной молекулы о стенку сосуда создадут силу m0υ 2/ l.
Учитывая, что в сосуде N молекул, и их направления движения равновероятны, без потери общности рассуждений можем предположить, что вдоль оси х движется 1/3 всех молекул, и их общая сила давления на стенку равна 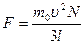 . Давление
. Давление 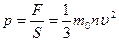 , где
, где 
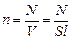 - концентрация молекул, т.е. их число в единице объема. Учтем, что скорости движения молекул различны, и вклад каждой молекулы в давление пропорционален квадрату ее скорости, тогда
- концентрация молекул, т.е. их число в единице объема. Учтем, что скорости движения молекул различны, и вклад каждой молекулы в давление пропорционален квадрату ее скорости, тогда
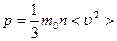 (4.2.1)
(4.2.1)
Здесь < υ 2> - среднее значение квадрата скорости, оно равно сумме квадратов скоростей всех молекул, деленной на их число. Эта величина также называется квадратом средней квадратичной скорости: 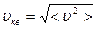 . Формула (4.2.1) выражает уравнение молекулярно-кинетической теории давления газа. Она показывает, что давление газа – статистический параметр, и равно среднему импульсу, переданному единице площади стенки сосуда в единицу времени при столкновении с ней молекул вследствие их теплового движения. Заметим, что газ, находящийся в состоянии термодинамического равновесия, такое давление будет оказывать на все стенки сосуда любой формы.
. Формула (4.2.1) выражает уравнение молекулярно-кинетической теории давления газа. Она показывает, что давление газа – статистический параметр, и равно среднему импульсу, переданному единице площади стенки сосуда в единицу времени при столкновении с ней молекул вследствие их теплового движения. Заметим, что газ, находящийся в состоянии термодинамического равновесия, такое давление будет оказывать на все стенки сосуда любой формы.
3. В рассмотренной модели идеального газа молекулы считаются материальными точками. Кинетическая энергия теплового движения 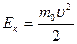 у разных молекул разная вследствие различия скоростей хаотического движения. Усредним ее по всем молекулам. и назовем средней кинетической энергией поступательного хаотического движения молекул < Eпост>. Она выражается формулой:
у разных молекул разная вследствие различия скоростей хаотического движения. Усредним ее по всем молекулам. и назовем средней кинетической энергией поступательного хаотического движения молекул < Eпост>. Она выражается формулой:
< Eпост>= 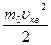 (5.2.2)
(5.2.2)
Основное уравнение кинетической теории газа можно записать еще и так:
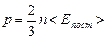 (5.2.3)
(5.2.3)
Уравнение (5.2.3) констатирует, что давление идеального газа зависит от концентрации молекул и их средней энергии поступательного движения. Формулы основного уравнения кинетической теории (5.2.1) и (5.2.3) связывают между собой величины, усредненные по всем молекулам: p, n, < Eпост>. Эти величины характеризуют не отдельную молекулу, а всю рассматриваемую термодинамическую систему – газ и являются характеристиками (параметрами) состояния газа. Таким образом, основное уравнение кинетической теории идеального газа является уравнением состояния идеального газа.
§ 5.3. Уравнение Клапейрона – Менделеева
1. Экспериментальное изучение поведения газов в XVII – XIX веках показало, что состояние газа определяют давление p, объем V и температура Т. Напомним, что температура характеризует степень нагретости тела. Абсолютная температура Т не бываем отрицательной,измеряется в кельвинах (К) и связана с температурой t, измеренной в градусах Цельсия так:
T = (t0C + 273)К (4.3.1)
p, V и Т называются параметрами (или термодинамическими параметрами) состояния газа, и они взаимосвязаны друг с другом. Уравнение, связывающее между собой параметры состояния, называется уравнением состояния. Оно было получено из опытных газовых законов Бойля-Мариотта, Гей-Люссака и Шарля и называется уравнением Клапейрона – Менделеева или уравнением состояния идеального[8] газа:
р V= 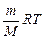 (4.3.2)
(4.3.2)
Здесь m – масса газа, M – молярная масса, R – универсальная (или молярная) газовая постоянная, в СИ R = 8,3 Дж/(моль.К). Напомним, что количество вещества 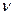 в СИ измеряют в моль, оно выражается так:
в СИ измеряют в моль, оно выражается так:
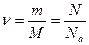 (4.3.3)
(4.3.3)
2. Используя понятие концентрации частиц и постоянную Больцмана
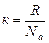 , ( к = 1,38.10-23 Дж/К) (4.3.4)
, ( к = 1,38.10-23 Дж/К) (4.3.4)
получаем еще одну формулу уравнения состояния газа:
р=пкТ (4.3.5)
Уравнение состояния содержит в себе, в частности, закон Авогадро, полученный из опыта. Он гласит, что при одинаковых температурах и одинаковых давлениях в одинаковых объемах любых газов содержится одинаковое число частиц. И это же уравнение содержит в себе опытный факт: при нормальных условиях [9] один моль любого газа занимает объем V=22,4 л. (Вспомните, сколько структурных единиц в 1 моль и оцените, сколько молекул в воздухе того помещения, где Вы сейчас находитесь).
[1] Номер формулы состоит из трех частей: первые две – номер параграфа, третья – порядковый номер формулы в этом параграфе. Номер параграфа содержит два числа: первое – номер главы, второе – порядковый номер параграфа главы.
[2] Только для таких малых углов можно применять векторные операции, например, векторное сложение по правилу параллелограмма. Для больших углов это правило не действует.
[3] В пределах этого объема еще не проявляется дискретность атомного строения вещества, но он достаточно мал, чтобы можно было считать, что свойства вещества одинаковые во всех его точках.
[4] В данном случае вектор обозначен не стрелкой над буквой, а жирным шрифтом. Модуль вектора, как и ранее, обозначен буквой не жирным шрифтом.
[5] 1 а.е.м.= 1/12 массы атома углерода »1,66.10-27 кг
[6] Даже если ln N=10, то N=2,710 > 1000, соответственно, 2,720>1000000=106
[7] Феномен (ударение на втором слоге) – явление (греч.)
[8] Чуть позже о термине «идеального»
[9] Нормальными называют такие условия: давление р=760 мм рт.ст = 105 Па (нормальное атмосферное давление), температура Т=273 К (00 С)
Дата добавления: 2022-01-22; просмотров: 12; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
