Откуда взялся новый коронавирус?
Апреля 2020
Компьютерные технологии против коронавируса: первые результаты

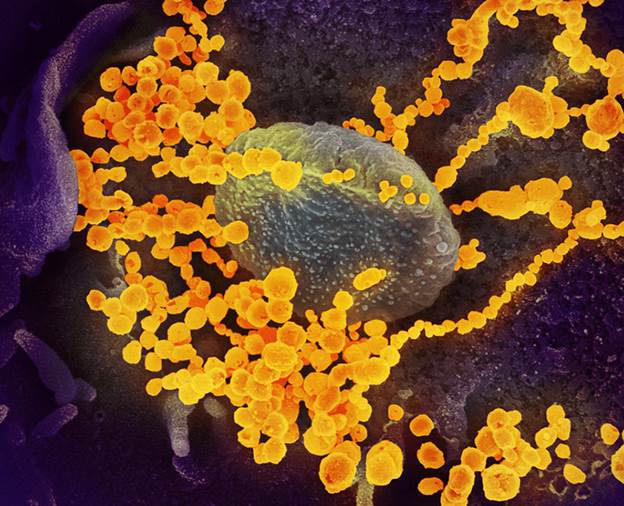
 Новый коронавирус застал человечество врасплох, но к борьбе с ним подключились новые технологии: на тропу войны вышли хемоинформатика и искусственный интеллект. На фото — вирионы SARS-CoV-2, выходящие из зараженной клетки.
Новый коронавирус застал человечество врасплох, но к борьбе с ним подключились новые технологии: на тропу войны вышли хемоинформатика и искусственный интеллект. На фото — вирионы SARS-CoV-2, выходящие из зараженной клетки.
· Авторы
o  Георгий Куракин
Георгий Куракин
o  Тимур Маджидов
Тимур Маджидов
Коронавирусы находятся в списке опасных патогенов с начала XXI в. В 2002 г. коронавирус вызвал эпидемию тяжелого острого респираторного синдрома (англ. severe acute respiratory syndrome, SARS), а в 2013 г. — ближневосточный респираторный синдром (англ. Middle East respiratory syndrome, MERS). В конце 2019 г. в Китае началась новая вспышка коронавирусной инфекции (англ. coronavirus disease, COVID-19), которая застала человечество врасплох. Вирус SARS-CoV-2, отличающийся довольно высокой инфицирующей способностью и смертностью, перекинулся на другие страны, и 11 марта ВОЗ объявила вспышку COVID-19 пандемией. В связи с этим перед учеными встала ключевая задача: в кратчайшие сроки разработать способы лечения и профилактики. На помощь в этом приходят передовые компьютерные технологии — молекулярное моделирование, виртуальный скрининг и искусственный интеллект. В продолжение ставшей уже такой популярной на «Биомолекуле» темы SARS-CoV-2 мы выкладываем (с некоторыми изменениями и дополнениями) исходно опубликованный в «Природе» обзор предварительных результатов разработки лекарственных препаратов против нового коронавируса с акцентом на применение компьютерных технологий.
|
|
|
С начала 2020 года весь мир следит за распространением коронавируса, который в декабре 2019-го вызвал эпидемию в Китае, а затем перекинулся и на другие страны. Поскольку эпидемия охватила весь мир , 30 января Всемирная организация здравоохранения объявила вспышку нового коронавируса (который поначалу именовался 2019-nCoV) чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение, а 11 марта — пандемией . Серьезность ситуации требует искать решение проблемы всеми возможными путями .
- Эпидемиологическая обстановка в мире быстро меняется. За актуальностью информации следит Университетский центр системных исследований и инженерии имени Джонса Хопкинса, практически в реальном времени выкладывая статистику на GitHub, на основе которой создана визуальная панель мониторинга распространения SARS-CoV-2.
- «Биомолекула» также пристально следит за развитием ситуации: «Хроника распространения SARS-CoV-2» [1].
- Помимо хроники, на «Биомолекуле» опубликовано еще несколько статей про новый коронавирус, которые уже снискали большую (и, увы, печальную) популярность: «2019-nCoV: очередной коронованный убийца?» [2] и дилогия «COVID-19: отвечаем на вопросы» [3] и «COVID-19: что мы знаем и чего не знаем» [4].
|
|
|
Китайские исследователи оперативно расшифровали и охарактеризовали геном нового коронавируса, обнаружив большое сходство с вирусом SARS-CoV (аббревиатура от англ. severe acute respiratory syndrome — коронавирус тяжелого острого респираторного синдрома), который был причиной эпидемии в 2002–2003 гг., а также с двумя коронавирусами летучих мышей, что стало основанием считать их природным резервуаром нового коронавируса, переименованного, соответственно, в SARS-CoV-2 [5–7]. Еще до публикации этих результатов его нуклеотидная последовательность была депонирована в базу данных GenBank. К 8 апреля на этом и подобных порталах собрали уже 566 геномов пандемического коронавируса из образцов, полученных в разных странах. Геномные исследования SARS-CoV-2 позволяют разрабатывать тесты для его выявления, строить филогенетические деревья, чтобы проследить его происхождение [66] и эволюцию и т.д. Кроме того, исследователи изучают 3D-структуры белков, механизмы инфицирования, ищут подходы для создания вакцин и лекарств — моноклональных антител и малых молекул. ВОЗ ведет базу данных публикаций и размещает на своем сайте новости по «противокоронавирусным» исследованиям.
|
|
|
Все результаты исследований незамедлительно публикуются в открытом доступе на сайтах научных журналов (Nature, Science, The Lancet, Journal of Medical Virology) и препринтов (bioRxiv, medRxiv и chemRxiv). За последние два месяца только на bioRxiv опубликовано более 80 статей о самых разных аспектах изучения SARS-CoV-2 и борьбы с ним. Важно подчеркнуть, что на всех сервисах размещено объявление о том, что статьи не прошли рецензирование и не должны рассматриваться как окончательные выводы, рекомендации по лечению или профилактике, а также не должны освещаться в СМИ как доказанная информация. Мы поддерживаем эти предостережения и призываем рассматривать нашу публикацию как научно-просветительский материал, изложенные в нем данные как предварительные и требующие дополнительного подтверждения, а сведения по лечению и профилактике COVID-2019 черпать только из официальных рекомендаций.
Откуда взялся новый коронавирус?
Впервые коронавирус человека выделили в 1965 г. из больного ОРВИ, а вскоре выяснилось, что коронавирусов много, и циркулируют они не только среди людей, но и среди домашних и диких животных [8]. Коронавирусы не считались опасными патогенами человека до тех пор, пока в 2002 г. мир не столкнулся с эпидемией SARS, которая началась в Китае и распространилась на 37 стран, поразив более 8 тыс. человек и погубив 774 (смертность более 9%) [9], [10]. В 2012 г. в Саудовской Аравии вспыхнула вторая эпидемия коронавируса, связанного с ближневосточным респираторным синдромом (англ. Middle-East respiratory syndrome , MERS), которым переболели почти 2,5 тыс. человек, 858 из которых погибли (смертность более 34%) [8]. После этих двух эпидемий стало ясно, что коронавирусы способны преодолевать межвидовые барьеры и переходить от животных к людям, а также что они могут представлять для людей серьезную опасность [11]. Эксперты предупреждали, что рано или поздно может возникнуть новая вспышка [12]. Это и случилось в 2019 г. — и снова в Китае, но никто не ожидал, что она охватит весь мир, то есть дорастет до размеров пандемии.
|
|
|
Во всех трех случаях естественным резервуаром коронавирусам послужили летучие мыши. Известно, что SARS-CoV изначально циркулировал среди подковоносых летучих мышей (Rhinolophus sinicus), а на человека перекинулся от небольшого лазающего млекопитающего из отряда хищных — малайской пальмовой циветты (Paradoxurus hermaphroditus) [13].
MERS-CoV также возник среди летучих мышей, а на пути передачи к человеку оказались одногорбые верблюды (Camelus dromedarius). Промежуточный хозяин SARS-CoV-2 пока точно не установлен. В конце февраля вышло несколько препринтов, в которых говорилось о довольно большом генетическом сходстве (85,5–92,4%) коронавирусов яванского панголина (Manis javanica) с вирусом, вызывающим COVID-19 [14]. Однако этого явно недостаточно, чтобы уверенно обвинить панголина (например, SARS-CoV имел 99,8% общих с коронавирусом циветты последовательностей, поэтому это животное стали считать источником вспышки «атипичной пневмонии»).
Интенсивные исследования нового коронавируса позволили Международному комитету по таксономии вирусов определить место SARS-CoV-2: его отнесли к роду Betacoronavirus семейства Coronaviridae отряда Nidovirales царства Riboviria (рис. 1)
Источник -[7].

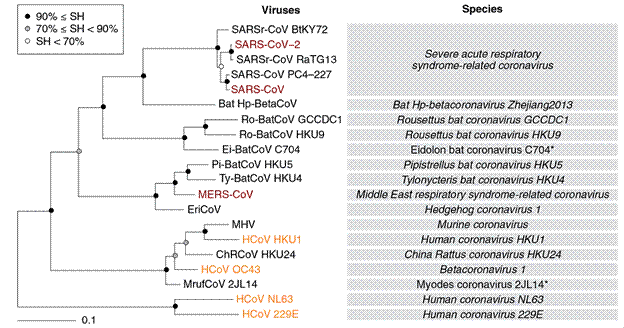
Рисунок 1. Филогенетическое древо коронавирусов, циркулирующих среди летучих мышей или людей, в том числе пяти видов рода Betacoronavirus, связанных с тяжелым острым респираторным синдромом. Красным цветом выделены зоонозные вирусы, проявившие патогенность к людям; коричневым — вирусы, циркулирующие среди людей и вызывающие у них незначительные респираторные проявления. Звездочками обозначены два вида коронавирусов, демаркация и названия которых ожидают одобрения Международного комитета по таксономии вирусов, так что они не выделены курсивом. SH — достоверность ветви, определенная по тесту Симодайра—Хасэгава (Shimodaira—Hasegawa). [7]
Как и у всех представителей Coronaviridae, вирион SARS-CoV-2 обрамляют булавовидные шипы гликопротеина, которые придают оболочке вируса сходство с солнечной короной (отсюда название), что хорошо заметно на электронной микрофотографии (рис. 2а). Этот поверхностный гликопротеин, или S-белок (от англ. spike — шип), отвечает за проникновение вируса в клетку путем имитации молекул, на которые реагируют трансмембранные рецепторы клеток. Помимо липидной оболочки, в которую заякорены еще два структурных белка — E (Envelope, оболочка) и М (Membrane), — у коронавируса есть внутренний нуклеокапсид из N-белка (Nucleocapsid), внутри которого скрыт геном вируса (плюс-цепь РНК) (рис. 2б).


Рисунок 2. Электронная микрофотография зрелых вирионов SARS-CoV-2 (а) и его 3D-модель (б)
Источник- Центры по контролю и профилактике заболеваний и Национальный институт аллергологии и инфекционных заболеваний США
SARS-CoV отличался от своих сородичей тем, что его «шипы» связываются с АПФ2 — ангиотензинпревращающим ферментом 2 (англ. angiotensin converting enzyme 2, ACE2), — «конкурентом» известного АПФ, являющегося мишенью лекарств для снижения давления. В то время как АПФ превращает неактивный ангиотензин I в повышающий давление ангиотензин II, АПФ2 расщепляет ангиотензин II до снижающего давление ангиотензина 1-7, тем самым уравновешивая действие АПФ. АПФ находится в крови, а АПФ2 – на мембранах клеток легких. Умение связываться с ним, по-видимому, и придает вирусу такую высокую способность вызывать пневмонию [8]. MERS-CoV пошел иным путем, нежели его «старший брат» из Китая, — S-белок MERS-CoV связывается с дипептидилпептидазой-4 (англ. dipeptidyl-peptidase, DPP4) [15], которая расщепляет инкретиновые гормоны и служит терапевтической мишенью для лечения сахарного диабета II типа. Помимо легких, DPP4 в большом количестве содержится в почках — поэтому MERS-CoV вызывает пневмонию с почечной недостаточностью одновременно [8].
В отличие от MERS-CoV, SARS-CoV-2 пошел по проторенной дорожке: его «шипы», как и у SARS-CoV, связываются с ACE2 клетки хозяина [16]. По геномной последовательности SARS-CoV-2 — близкий родственник SARS-CoV, но отличается от него и MERS-CoV меньшей смертностью (к нашему счастью), хотя и гораздо большей заразностью. Это и позволило ему распространиться гораздо шире, чем в две предыдущие коронавирусные эпидемии. Очевидно, что против SARS-CoV-2 нужны специфические лекарства.
Как найти лекарство?
Несмотря на 15-летнюю историю контакта с опасными коронавирусами и ожидание новых вспышек, человечество не успело разработать специфического противокоронавирусного средства [17]. Даже более или менее испытанных терапевтических стратегий мало. Во время прежних вспышек применяли антивирусные препараты широкого действия рибавирин и интерферон-альфа [10]. В случае вирусов это означает, что эффект не гарантирован, а побочные действия не вполне предсказуемы. Впрочем, рибавирин продемонстрировал эффективность против SARS-CoV [18], но нужны более крупные и тщательные исследования .
Речь идет о клинических исследованиях, с помощью которых строго доказывают эффективность и безопасность всех лекарственных средств, прежде чем применять их на практике. Как это делается, можно прочесть в спецпроекте о клинических исследованиях.
На животных, зараженных SARS-CoV и MERS-CoV, показал эффективность другой противовирусный препарат широкого спектра — ремдесивир, который изначально был разработан для лечения лихорадки Эбола. О старте первых клинических исследований ремдесивира объявили в конце февраля Национальные институты здоровья США с планируемой датой окончания к 2023 году; однако сейчас таких исследований зарегистрировано уже 10, и первые результаты вскоре должны появиться. Неплохо себя зарекомендовал и другой противовирусный препарат широкого спектра действия — фавипиравир (рис. 3).

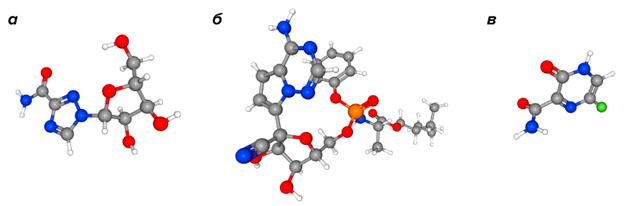
Рисунок 3. Препараты, применяемые для лечения коронавирусной инфекции. а — рибавирин, б — ремдесивир, в — фавипиравир.
Комбинация препаратов для лечения СПИДа (ингибиторы протеазы ВИЧ) — лопинавира с ритонавиром — оказалась эффективна в эксперименте на клеточной культуре и при лечении SARS [18], поэтому китайские ведомства, ответственные за борьбу с коронавирусом, некоторое время официально рекомендовали использовать ее для лечения COVID-19 [19]. Впрочем, уже в марте 2020 года показали, что для людей эта комбинация неэффективна.
Очевидно, что имеющегося арсенала недостаточно. Фармацевтическая отрасль оказалась застигнута врасплох, хотя ученые и прогнозировали появление нового коронавируса. Необходимо срочно разрабатывать новые лекарства для борьбы с инфекцией. На какие мишени они должны быть нацелены?
Интересующихся фармакологией приглашаем прочесть нашу статью про «Поиск лекарственных мишеней» [20].
Геномы коронавирусов — самые большие среди РНК-содержащих вирусов, но мало того, что размер генома SARS-CoV-2 — около 30 тыс. нуклеотидов [21], так у него еще и довольно сложный жизненный цикл (рис. 4). Однако сложное устройство легче «сломать», то есть потенциальных мишеней для лекарственного воздействия в SARS-CoV-2 достаточно (рис. 5). Но лекарство должно защищать не только от текущей вспышки, но и других инфекций, вызванных другими штаммами коронавируса, которые могут появиться в любой момент. Здесь приходится включать эволюционную логику и «прицеливаться» в белки, которые в ходе эволюции коронавирусов меняются мало (так называемые консервативные мишени). Одним из таких белков является главная протеаза вируса (Mpro) — ее и используют как главную мишень для разработки низкомолекулярных антикоронавирусных лекарств [22], [23].

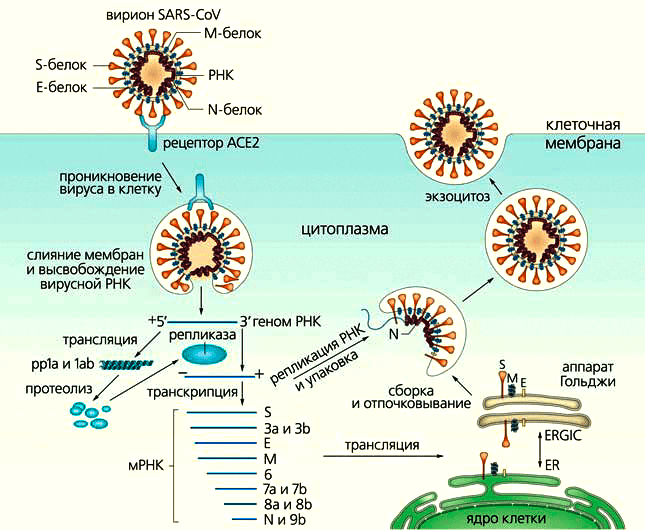
Рисунок 4. Жизненный цикл SARS-CoV. Его вирион проникает в клетку путем эндоцитоза: S-белок, прикидываясь «своим», связывается с ее рецептором (ACE2), затем расщепляется, вследствие чего мембраны вируса и эндосомы сливаются, и РНК выходит в цитоплазму. Геном транслируется в полипротеины (pp1a и 1ab), с помощью которых формируется копия РНК вируса, а также транскрибируется восемь мРНК-шаблонов для генерации его белков в просвете (ERGIC) между эндоплазматическим ретикулумом (ER) и аппаратом Гольджи [24]. Вирионы собираются в цитоплазме и выходят из клетки путем экзоцитоза [9], [11], [17].
Источник-[25]

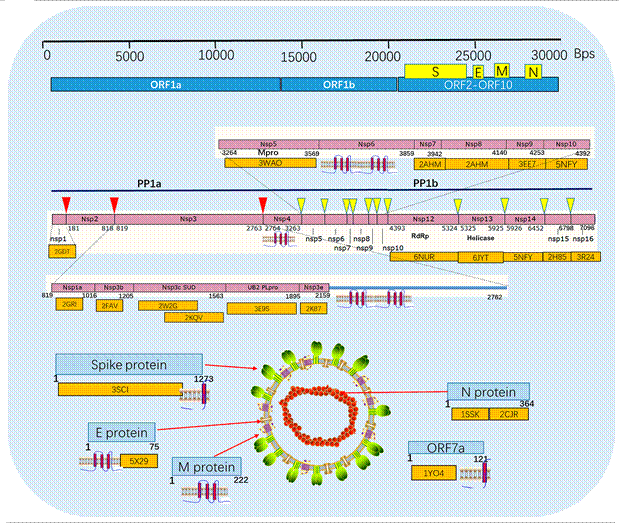
Рисунок 5. Наглядное изображение генома коронавируса и его структурных элементов — возможных терапевтических мишеней. Главная протеаза обозначена 3WAO.
Источник-[17]
Компьютерный дизайн лекарств
Главная проблема дизайна молекул против коронавируса заключается в том, что времени на создание принципиально нового лекарства попросту нет. Даже если молекулу-кандидата удастся найти очень быстро (что далеко не факт), доклинические и клинические испытания продлятся годы.
К счастью, смертность от COVID-19, по сравнению с SARS и MERS, весьма невелика, но это накладывает существенные требования к безопасности потенциального лекарства. Риск от его применения должен быть существенно ниже, чем от самой болезни. А значит, лекарство должно быть безопасным. Это сильно осложняет поиск: есть вероятность, что на этапе клинических испытаний будет выявлен слишком большой риск от приема препарата, несоизмеримый с опасностью болезни.
Отсюда возникла идея — не надо разрабатывать новые лекарства! Нужно использовать старые, то есть найти такие соединения, доклинические испытания которых проведены, безопасность доказана, и остается только проверить активность против SARS-CoV-2. Это называется перепрофилированием лекарств. В связи с этим можно выделить три стратегии разработки лекарства:
- Перепрофилирование других противовирусных препаратов. Как мы уже писали, можно попытаться использовать против SARS-CoV-2 препараты с широким противовирусным потенциалом, которые показали эффективность против РНК-вирусов (например, ВИЧ). Это самый быстрый и надежный способ с высоким шансом на успех, правда, эффективность может быть не очень велика, поскольку препарат не «настраивался» специально против коронавируса. Итак, можно попытаться использовать ингибиторы протеазы Mpro или РНК-полимеразы вируса, и именно по этому пути в настоящее время идут клинические испытания. Кроме того, этот подход не расширяет инструментария против вирусов. Он позволяет добиться тактической победы, но в долгосрочной перспективе — не самый лучший. А мы уже убедились, что новых коронавирусов нужно ждать постоянно. Да и не они одни образуют проблему «новых патогенов» — ранее незнакомых нам возбудителей с высоким эпидемическим потенциалом.
- Перепрофилирование других лекарств, не показавших активность против вирусов. Они хороши тем, что их профиль безопасности известен. Если имеются сведения, что какое-либо лекарство может иметь активность против коронавируса, можно пропустить стадию изучения его безопасности (пожалуй, самая долгая и дорогая часть доклинических испытаний и первая стадия клинических) — необходимо только изучить его эффективность (разумеется, с оговоркой, что профиль токсичности у больных коронавирусом может отличаться от такового у других пациентов: так, коронавирусу особенно подвержены люди с гипертензией и сахарным диабетом, и для них могут оказаться токсичными или плохо сочетаться с другими принимаемыми препаратами лекарства, которые подходят всем остальным; поэтому риск все равно есть). Шанс на успех в этом случае меньше. К примеру, не раз было показано, что противомалярийный препарат хлорохин эффективен против вирусов in vitro. Сейчас проводятся клинические испытания против COVID-19, но этот препарат уже не раз проваливался в испытаниях на людях [26].
- Поиск в существующих базах данных химических соединений (реальных или виртуальных). Можно пытаться придумать структуру, эффективную против коронавируса, на основе структуры биологической мишени (какой-нибудь макромолекулы коронавируса, которую надо заблокировать), или использовать методы искусственного интеллекта, способные генерировать структуры молекул, потенциально обладающих нужными свойствами. В любом случае эти молекулы будут новыми, с неизвестной фармакокинетикой и фармакодинамикой, которые нужно изучать и оптимизировать. С одной стороны, на исследования уйдут годы, но с другой — будет создан препарат с принципиально новым видом активности, «настроенной» против коронавируса. В будущем от него может быть и другая польза. Так, препарат N3, который разрабатывался против коронавируса SARS-CoV 2003 г., пригодился при расшифровке структуры протеазы коронавируса 2019 г. Это лучший путь в долгосрочной перспективе, хотя он самый дорогой и долгий.
Таким образом, единственно правильного пути нет. Каждый имеет достоинства и недостатки, но в целом эти три стратегии дополняют друг друга и способны помочь человечеству побороть COVID-19. По этой причине работы ведутся во всех направлениях.
Чаще всего в поиске новых лекарств используется методика докинга (или молекулярной стыковки) . В докинге оценивается, возможно ли проникновение молекулы в «связывающий карман» биологической мишени и эффективное взаимодействие с ней. Для этого используется специальная оценочная функция, обычно основанная на методике эмпирических силовых полей. Это один из самых распространенных и эффективных методов компьютерного моделирования связывания лекарства с рецептором. Чаще всего при поиске новых лекарств используется библиотека соединений-кандидатов и трехмерная структура молекулярной мишени. В дальнейшую разработку поступают лидерные молекулы, показавшие по результатам моделирования максимальную энергию связывания. Такой подход называется виртуальным скринингом.
Докинг и другие компьютерные методики рассмотрены в публикациях «Виртуальные тропы реальных лекарств» [27] и «12 методов в картинках: “сухая” биология» [28], а сама область рационального конструирования лекарств — в статье «Драг-дизайн: как в современном мире создаются новые лекарства» [29] и книге «От оргазма до бессмертия. Записки драг-дизайнера» [30].
Беда в том, что SARS-CoV-2 появился внезапно, а для расшифровки трехмерной структуры его белков требовалось время. Но геном уже расшифрован, а следовательно, известна и последовательность аминокислот в его белках! В таком случае можно получить приблизительную 3D-структуру путем моделирования по гомологии . С помощью специальных программ по базам данных находят белки, сходные по последовательности с исследуемым, имеющие общее с ним эволюционное происхождение (это и называется гомологией), и, что важно, для которых уже расшифрована трехмерная структура. Ее используют как шаблон, на который с помощью других программ буквально «натягивают» исследуемый белок. Затем может следовать процедура небольшой «подгонки», чтобы смоделированный белок «улегся поудобнее» — скорее всего, так он и будет сворачиваться в естественных условиях.
Как это делается, читайте в статье «Торжество компьютерных методов: предсказание строения белков» [31].
Именно этот подход применили китайские ученые, которые использовали в качестве шаблона для моделирования протеазу Mpro SARS-CoV — ту самую «первую ласточку» из 2002 г. [23]. Эта структура доступна всем в банке данных PDB под кодом 2GTB [22]. Библиотека для докинга включала 1900 лекарств. Но более трети из них имели высокие значения расчетной энергии связывания. Сократить круг поиска помог отбор молекул, связывающихся с протеазой аналогично известным веществам. Этот поиск также проводили с помощью вычислительной техники. Так список сократился до 159.
Далее исследователи визуализировали модели полученных комплексов и «на глаз» выбрали 15 структур. Их использовали для более точного метода — моделирования движений молекул во времени (молекулярной динамики ). В результате «победителем» оказался нелфинавир — противовирусное средство, которое уже используется против ВИЧ. Кроме того, исследователи посчитали потенциально интересными препарат для снижения холестерина питавастатин, антипсихотический препарат перампанел и празиквантел, применяющийся против гельминтов. Однако последние три интересны скорее как стартовые соединения для дальнейшей оптимизации.
И об этом методе есть статья на «Биомолекуле»: «Молекулярная динамика биомолекул. Часть I. История полувековой давности» [32].
26 января 2020 г. «на подмогу» исследователям подоспела экспериментально определенная структура Mpro самого SARS-CoV-2, да еще и в комплексе с известным блокатором N3! Она также доступна в банке данных PDB для «всеобщего обозрения» под кодом 6LU7 (рис. 6). Виртуальный скрининг стал проще. И снова в исследовании появляются препараты против ВИЧ: ученые использовали их как инструмент для сравнения связывающих участков Mpro «старого» (SARS-CoV) и «нового» (SARS-CoV-2) коронавирусов [33]. Моделирование показало, что исследуемые «карманы» в белке связывают лекарство сходным образом. Далее ученые предприняли виртуальный скрининг, используя в качестве библиотеки базу данных DrugBank. Они выявили 10 препаратов-«лидеров», но результаты несколько разочаровали. Бóльшая часть этих соединений не имело никакого отношения к вирусам, а сам спектр соединений довольно пестрый: от антипсихотиков до противогрибковых агентов. Ни проверки идеи, ни даже оптимизации «находок» не последовало. Впрочем, данная работа — препринт, как и предыдущая. А значит, пока это лишь предварительные данные.

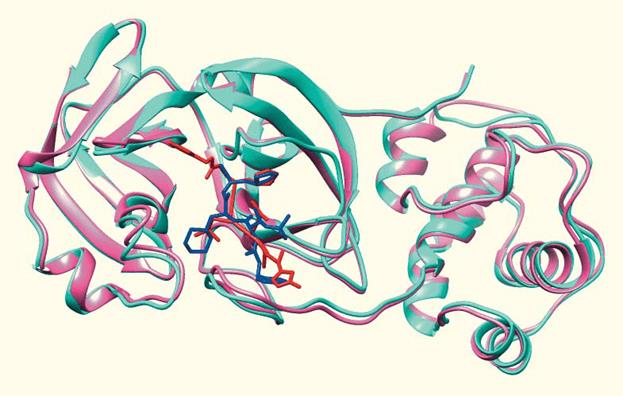
Рисунок 6. Наложение недавно расшифрованной протеазы SARS-CoV-2 (розовая, связана с красным блокатором) на гомологичную протеазу SARS-CoV (голубая, связана с синим ингибитором). Обратите внимание на сходство структуры протеаз и положения блокаторов в активном центре (хотя это разные блокаторы). Изображение сделано авторами статьи [35] на основе структур PDB 6lu7 (DOI: 10.2210/pdb6LU7/pdb) и 2gx4 (DOI: 10.2210/pdb2GX4/pdb).
Другая группа китайских ученых получила более надежные результаты [34]. Их библиотека включала 8 тыс. лекарств. В результате скрининга обнаружилось 690 «лидеров». Однако эта группа исследователей, в отличие от предыдущей, исключила «неинтересные» молекулы: красители, токсичные вещества, препараты, применяемые в неврологии (в вирусологии им делать нечего) и противоопухолевые лекарства с высокой токсичностью. Это помогло не только снять один лишний вопрос к своей работе, но и сократить «шорт-лист» до 50 кандидатов. Из этого вполне разумного количества авторы выделили четыре соединения: прулифлоксацин (фторхинолоновый антибиотик), биктегравир (ингибитор интегразы ВИЧ), нелфинавир (уже упоминавшийся ингибитор протеазы ВИЧ) и тегобувир (препарат от гепатита С) (рис. 7).

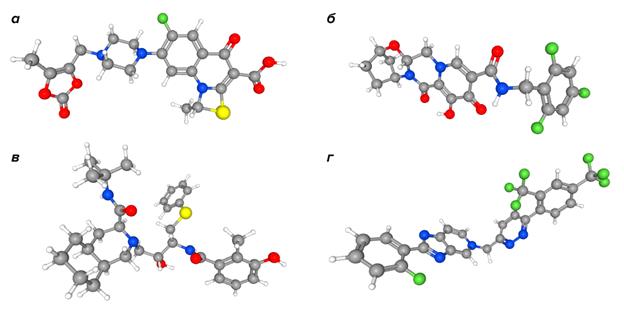
Рисунок 7. Вещества-«победители» в докинге. а — прулифлоксацин, б — биктегравир, в — нелфинавир, г — тегобувир.
В общем, виртуальный скрининг и докинг показали свою привлекательность в деле борьбы с коронавирусом. Работы с использованием этого инструмента продолжаются очень активно, правда есть и проблема: пока у этих работ нет экспериментального подтверждения, но это дело времени. Нужно помнить, что в большинстве лабораторий этого штамма еще просто нет, и обучение работе с ним займет время (а также, в связи с опасностью вируса, такие лаборатории должны быть особо сертифицированы). В этом смысле создание международных консорциумов представляется особенно перспективным, и они в настоящее время уже формируются.
Дата добавления: 2022-01-22; просмотров: 21; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
