По способу перекрывания электронных орбиталей различают ковалентные связи сигма- и пи.
В молекуле азота одна общая электронная пара образуется за счет сигма-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания р-орбиталей в двух областях; пи-связь менее прочна, чем сигма-связь.
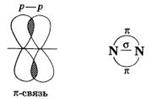
В молекуле азота между атомами существует одна сигма-связь и две пи-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных р-электрона каждого атома).
Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
S—s (Н2),
S-р (НСl),
Р-р (Сl2),
а также за счет перекрывания «чистых» и гибридных орбиталей:
S-sр3 (СН4)
sр2—sр2 (С2Н4) и т. д.
По числу общих электронных пар, связывающих атомы, то есть по кратности, различают ковалентные связи:
1) одинарные:

2) двойные:
СО,
о=с=о
оксид углерода (IV)
3) тройные:
С2Н2
НСΞСН ацетилен
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной.
При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО) — свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной.
|
|
|
Посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.
Значения относительной электроотрицательности фосфора и водорода практически одинаковы: ЭО (Н) = 2,1; ЭО (Р) = = 2,1, поэтому в молекуле фосфина РН3 связи между атомом фосфора и атомами водорода ковалентные неполярные.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной
Например:
NH3
аммиак
Азот — более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.

Следует различать полярность молекулы и полярность связи.
Полярность связи зависит от значений электроотрицательности связанных атомов, а полярность молекулы зависит и от полярности связи, и от геометрии молекулы.
Например, связи в молекуле углекислого газа СО2 будут полярными, а молекула не будет полярной, так как имеет линейное строение.
Молекула воды Н2О полярна, так как образована с помощью двух ковалентных полярных связей Н → О и имеет угловую форму. Валентный угол НОН составляет 104,5°, поэтому у атома кислорода с частичным отрицательным зарядом δ- и двумя неподеленными электронными парами формируется отрицательный полюс молекулы, а у атомов водорода с зарядом δ+ — положительный.
|
|
|
Молекула воды — диполь.
Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов:
атомной — очень прочной (алмаз, графит, кварц);
молекулярной — в обычных условиях это газы, легколетучие жидкости и твердые, но легкоплавкие или возгоняющиеся вещества (Сl2, Н2О, иод I2, «сухой лед» СО2 и др.).
Внутримолекулярная ковалентная связь прочная, но межмолекулярное взаимодействие очень слабое, вследствие чего молекулярная кристаллическая решетка непрочная.
Дата добавления: 2021-12-10; просмотров: 40; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
