Химическая связь, образованная элементами, электроотрицательность которых одинакова, называется неполярной ковалентной связью.
Например в молекулах: Н2, О2, I2.
Общая электронная пара находится на одинаковом расстоянии от ядер обоих атомов.
Химическая связь, образованная элементами электроотрицательность которых отличается незначительно, называется ковалентной полярной связью.
Например в молекулах: НСl, H2S.
Н• + •  : → Нσ+
: → Нσ+  :
:  :σ- Общая электронная пара смещается в сторону хлора как более электроотрицательного элемента, поэтому молекула хлороводорода полярна.
:σ- Общая электронная пара смещается в сторону хлора как более электроотрицательного элемента, поэтому молекула хлороводорода полярна.
К ковалентным полярным связям относят связи, образованные по донорно-акцепторному механизму: Атом азота имеет неподеленную электронную пару, а ион водорода

 Н Н + - свободную орбиталь. По этой причине между ними возникает
Н Н + - свободную орбиталь. По этой причине между ними возникает
 H :
H : 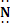 : + Н+ → H :
: + Н+ → H : 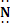 :Н дополнительная ковалентная связь по донорно-акцепторному
:Н дополнительная ковалентная связь по донорно-акцепторному
Н Н механизму. В результате образуется ион аммония.
3.Металлическая связь – это связь между положительно заряженными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
 Атомы Ме легко отдают наружные
Атомы Ме легко отдают наружные  и некоторые из них превращаются в «+» заряженные ионы. Оторвавшиеся от атомов металла
и некоторые из них превращаются в «+» заряженные ионы. Оторвавшиеся от атомов металла  свободно перемещаются между образовавшимися «+» ионами металла. Между положительно заряженными ионами металла и отрицательно заряженными электронами возникают силы электростатического притяжения. Электроны как бы цементируют слои положительно заряженных ионов металла. Так обуславливается стабильность решетки. Такие кристаллические решетки называются металлическими.
свободно перемещаются между образовавшимися «+» ионами металла. Между положительно заряженными ионами металла и отрицательно заряженными электронами возникают силы электростатического притяжения. Электроны как бы цементируют слои положительно заряженных ионов металла. Так обуславливается стабильность решетки. Такие кристаллические решетки называются металлическими.
|
|
|
4. Водородная связь - связь между атомами водорода одной молекулы и атомами ЭО элементов другой молекулы.(О, F, N).
Например:
Н σ+- О σ- . . . Н σ+- О σ- . . . Н σ+- О σ- . . .
│ │ │
R R R
• В молекулах спирта углеводородный радикал и атом кислорода находятся под углом друг к другу. Связь О-Н полярна => на атоме водорода образуется частичный положительный заряд, а на атоме кислорода частичный отрицательный заряд. Поэтому атом кислорода одной молекулы спирта может взаимодействовать с атомом водорода другой. Это взаимодействие называется водородной связью. Прочность водородной связи значительно меньше прочности обычной ковалентной связи (примерно в 10 раз) Длина – 0,176 нм,
Еразр = 17-22 кДж/моль.
• За счет водородных связей молекулы спирта оказываются ассоциированными, как бы прилипшими друг к другу. Поэтому спирты являются жидкостями.
|
|
|
Одинарные и кратные связи в органических соединениях.
Одинарные связи в органических соединениях – это σ-связи.
Сигма-связь – это связь, наибольшая плотность которой лежит на прямой, соединяющей ядра атомов. Это могут быть связи:

 Вокруг σ-связи возможно свободное вращение атомов.
Вокруг σ-связи возможно свободное вращение атомов.
Кратные связи в органических соединениях – это двойные и тройные связи. Двойная связь состоит из одной σ-связи и одной π-связи, а тройная связь - из одной σ-связи и двух π-связей.
π-связь – химическая связь образованная боковым перекрытием р-облаков, наибольшая плотность которой лежит на над и под линией, соединяющей ядра атомов.

 Кратные связи образованы неравноценными связями: σ-связь более
Кратные связи образованы неравноценными связями: σ-связь более
 π-связь прочная (Еразр =350кДж/моль). π-связь легче рвется (Еразр=270кДж/моль)
π-связь прочная (Еразр =350кДж/моль). π-связь легче рвется (Еразр=270кДж/моль)
и более реакционноспособна.
Вокруг кратных связей невозможно свободное вращение атомов.
|
|
|
Типы кристаллических решеток:
1.  Ионные кристаллические решетки – в узлах кристаллической решетки находятся ионы, которые связаны ионной связью. Вещества твердые, тугоплавкие, многие растворимы в воде. Растворы и расплавы проводят ток. К ним относятся: соли (NaCl, CuSO4), основания (NaOH), основные оксиды (CaO).
Ионные кристаллические решетки – в узлах кристаллической решетки находятся ионы, которые связаны ионной связью. Вещества твердые, тугоплавкие, многие растворимы в воде. Растворы и расплавы проводят ток. К ним относятся: соли (NaCl, CuSO4), основания (NaOH), основные оксиды (CaO).
 2. Атомные кристаллические решетки – в узлах кристаллической решетки лежат атомы, которые связаны ковалентными связями (полярными и неполярными). Вещества очень твердые, прочные, тугоплавкие, практически нерастворимы в воде. К ним относятся: алмаз, графит, кремний и его соединения с кислородом и углеродом ( SiO2 – кварц, SiC – карборунд).
2. Атомные кристаллические решетки – в узлах кристаллической решетки лежат атомы, которые связаны ковалентными связями (полярными и неполярными). Вещества очень твердые, прочные, тугоплавкие, практически нерастворимы в воде. К ним относятся: алмаз, графит, кремний и его соединения с кислородом и углеродом ( SiO2 – кварц, SiC – карборунд).
 3. Молекулярные кристаллические решетки – состоят из молекул (полярных и неполярных), которые связаны слабыми межмолекулярными силами. Образованы веществами с ковалентной связью( полярной и неполярной). Вещества имеют малую твердость, низкие температуры плавления. При н.у. это газы или жидкости. К ним относятся: кислоты (HCl, H2SO4), кислотные оксиды (CO2), вода (Н2О), газы: кислород О2, водород Н2, азот N2 и т.д.
3. Молекулярные кристаллические решетки – состоят из молекул (полярных и неполярных), которые связаны слабыми межмолекулярными силами. Образованы веществами с ковалентной связью( полярной и неполярной). Вещества имеют малую твердость, низкие температуры плавления. При н.у. это газы или жидкости. К ним относятся: кислоты (HCl, H2SO4), кислотные оксиды (CO2), вода (Н2О), газы: кислород О2, водород Н2, азот N2 и т.д.
 4. Металлические кристаллические решетки - в узлах кристаллической решетки лежат атомы металла, положительно заряженные ионы металла, между которыми свободно движутся электроны. Между положительно заряженными ионами металла и отрицательно заряженными электронами возникают силы электростатического притяжения. Электроны как бы цементируют слои положительно заряженных ионов металла. Так обуславливается стабильность решетки. Такие кристаллические решетки называются металлическими.
4. Металлические кристаллические решетки - в узлах кристаллической решетки лежат атомы металла, положительно заряженные ионы металла, между которыми свободно движутся электроны. Между положительно заряженными ионами металла и отрицательно заряженными электронами возникают силы электростатического притяжения. Электроны как бы цементируют слои положительно заряженных ионов металла. Так обуславливается стабильность решетки. Такие кристаллические решетки называются металлическими.
|
|
|
Вывод: Тип химической связи определяет во многом строение данного вещества, а также его
физические и химические свойства.
Задание:
Определить вид химической связи, тип кристаллической решетки, составить схему образования молекулы.
а) NH3 б) О2 в) СО2 г) MgCl2 д) С2Н4
Дата добавления: 2021-12-10; просмотров: 41; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
