Связь, образованная посредством общих электронных пар, называется ковалентной.
План – конспект урока 11 класс
Виды химической связи: ионная, ковалентная (полярная, неполярная), металлическая, водородная. Простые и кратные связи в органических соединениях. Типы кристаллических решеток.
При образовании молекул простых или сложных веществ, между атомами возникает химическая связь. Существует несколько видов химической связи: ионная, ковалентная, металлическая, водородная. Один из существенных показателей, определяющих, какая связь образуется между атомами – это электроотрицательность.
Электроотрицательность – способность атомов в соединениях притягивать к себе электроны от других атомов.
Электроотрицательность возрастает:
· В периодах – слева направо
· В главных подгруппах снизу вверх.
Вид связи зависит от разности значений ЭО соединяющихся атомов. Чем больше ЭО элементов образующих соединение, тем полярнее связь между ними.
Таблица
| Признаки сравнения | Вид химической связи | ||||
| Ионная | Ковалентная | Металлическая | Водородная | ||
| Неполярная | Полярная | ||||
| 1. Природа, связанных х. эл. | |||||
| 2. Способ образования хс | |||||
| 3.Механизм образования хс | |||||
| 4.Тип кристалл. Решетки | |||||
| 5.Структурные элементы кр.р. | |||||
| 6.Физические свойства в-в | |||||
| 7.Примеры в-в | |||||
|
|
|
1. Ионная связь – связь образованная за счет электростатического притяжения между
Ионами.
Ионная связь образуется между атомами элементов с резко отличающейся электроотрицательностью (между Ме и неМе). При этом происходит переход электронов от менее электроотрицательного элемента к более электроотрицательному элементу. Рассмотрим образование молекулы хлорида натрия. У натрия на наружном слое содержится 1  , который он легко отдает
, который он легко отдает 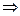 его электроотрицательность мала. У хлора на наружном слое 7
его электроотрицательность мала. У хлора на наружном слое 7  , поэтому он легко принимает 1
, поэтому он легко принимает 1 
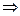 его электроотрицательность велика. Поэтому натрий отдает свой наружный электрон хлору. Наружный электрон натрия полностью переходит на наружный
его электроотрицательность велика. Поэтому натрий отдает свой наружный электрон хлору. Наружный электрон натрия полностью переходит на наружный
 Na• + •
Na• + •  : →Na+ [:
: →Na+ [:  :]- слой хлора, в результате чего образуются заряженные частицы -
:]- слой хлора, в результате чего образуются заряженные частицы -
ионы. Между ионами возникают силы электростатического притяжения, т.е. образуется ионная связь.
2. Ковалентная связь – устанавливается между элементами с одинаковой или незначительно отличающейся электроотрицательностью.
Рассмотрим образование связи между двумя атомами водорода.
|
|
|





 При сближении атомов положительно заряженное ядро одного
При сближении атомов положительно заряженное ядро одного
+_ + +_ = + ¯¯ + атома водорода притягивает отрицательно зараженное электронное облако другого атома и наоборот. В результате происходит перекрывание электронных облаков и образуется область повышенного отрицательного заряда, которая уравновешивает взаимное отталкивание положительно заряженных ядер. Электроны спариваются и образуют одно общее электронное облако.
Н• + •Н → Н:Н Они теперь принадлежат обоим атомам и образуют общую
электронную пару.
Связь, образованная посредством общих электронных пар, называется ковалентной.
Ковалентная связь устанавливается между атомами одного или разных неметаллов. Поэтому различают ковалентную полярную и неполярную связи.
Дата добавления: 2021-12-10; просмотров: 30; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
