Загрязнение окружающей среды при авариях. Экологический риск
Оборудование для систем термического окисления.
Для обезвреживания газовых промышленных выбросов используют термические методы прямого и каталитического сжигания. Метод прямого сжигания применяют для обезвреживания промышленных газов, содержащих легко окисляющиеся органические примеси, например пары углеводородов. Продуктами сгорания углеводородов являются диоксид углерода и вода, а органических сульфидов — диоксид серы и вода.
Из всех окислительных процессов для термообезвреживания пригодны исключительно реакции с кислородом, поскольку при участии иных окислителей принципиально невозможно получить безвредные продукты окисления. Поэтому далее под термином "окисление" подразумевается процесс, окислителем в котором служит кислород.
Газофазный процесс термоокисления осуществляют непосредственной огневой обработкой (сжиганием в пламени) газовых выбросов при температурах, превышающих температуру воспламенения горючих компонентов выбросов.
Газы сжигают на установках с открытым факелом или в печах различных конструкций. Прямое сжигание осуществляют при 700…800°С с использованием газообразного или жидкого топлива. Для сжигания необходим избыток кислорода на 10…15% больше стехиометрического количества. Если теплоты сгорания углеводородов достаточно, чтобы теплота реакции превышала 1,9 МДж/м3, газы также сжигают в факеле. Чтобы пламя факела было некоптящим, добавляют воду в виде пара. В этом случае происходит реакция водяного пара с углеводородами, сопровождаемая образованием водорода и оксида углерода.
|
|
|
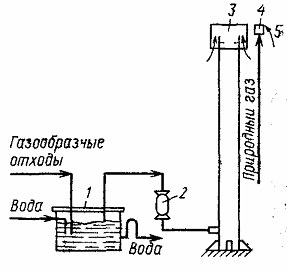
Рис. 1. Установка для факельного сжигания газообразных отходов:
1 – гидрозатвор; 2 – огнепреградитель; 3 – основная горелка; 4 – дежурная горелка; 5 – система зажигания дежурной горелки
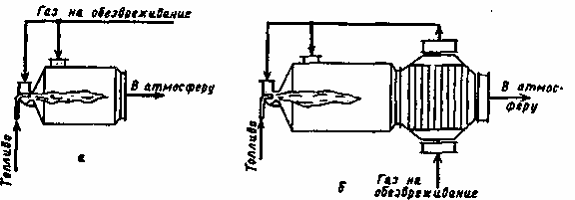
Рис. 2. Схемы термических нейтрализаторов промышленных отходящих газов: а - без теплообменника; б - с теплообменником
Конструкции топочных устройств для печей термообезвреживания можно разделить на камерные, циклонные, шахтные и барабанные. Наиболее распространены вертикальные и горизонтальные камерные (рис. 3, а), а также циклонные горизонтальные (рис. 3, б) конструкции.

Рис. 3. Схемы термических нейтрализаторов промышленных
отходящих газов: а - без теплообменника; б - с теплообменником
2. Удаление диоксида серы и сернистых соединений из отходящих газов. Основные методы, технологические схемы, сооружения
Очистка от диоксида серы и сероводорода
Для очистки газов от диоксида серы SO2 применяются методы абсорбционные, адсорбционные и каталитические.
Наиболее распространены абсорбционные методы. Поглотителями служат вода, сульфит натрия, гидрат окиси аммония, сульфит аммония и др. Использованный сорбент подвергается регенерации и может быть возвращен в процесс.
|
|
|
Абсорбция диоксида серы водойявляется простейшим способом очистки газов от диоксида серы. Он основан на большой растворимости диоксида серы в воде. Растворимость увеличивается, если вода имеет карбонатную жесткость. При взаимодействии диоксида серы с водой происходит реакция
SO2 + Н2О = Н2SO3
При применении этого метода не предполагается утилизация уловленного диоксида серы. Перед спуском в водоем отработанная вода подлежит нейтрализации, поскольку обладает высокой кислотностью. Диоксид серы малорастворим в воде. Поэтому для данного способа очистки требуется большой расход воды и абсорберы большого объема. Раствор нагревают до 100°С. Абсорбция диоксида серы водой связана с большими энергозатратами. В качестве абсорбента используют морскую воду, имеющую слабощелочную реакцию. Благодаря этому растворимость в ней диоксида серы повышается. Схема установки показана на рис.1.
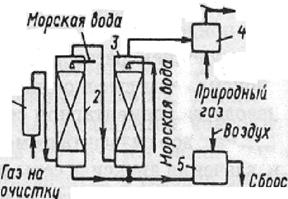 |
Рис.1. Схемы установки абсорбции диоксида серы морской водой:
1 — электрофильтр; 2, 3 — абсорберы; 4 — подогреватель; 5— реактор.
|
|
|
Известковый способ. Газ предварительно очищается от взвешенных частиц. В скруббере газ, содержащий диоксид серы, промывается известковым молоком (гидрат оксида кальция) (рис.2.).Реакция проходит по уравнению SO2+Са(ОН)Н2= CaSO3+Н2О. При применении этого способа достигается высокая эффективность очистки. Недостаток — большой расход извести.
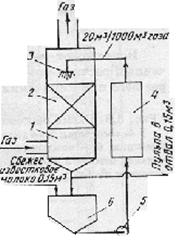 |
Схема известкового метода очистки газов от SO2: 1 – скруббер; 2 - насадка; 3- брызгало; 4-кристаллизатор; 5-насос; 6-приемный бак.
На орошение скруббера необходимо подавать большое количество жидкости, чтобы насадка скруббера не засорялась образовавшимися Са SO3 и гипсом (CaSO4 ∙ 2Н2О). Поэтому применяют многократную циркуляцию пульпы. На 1000 м очищаемого газа при концентрации диоксида серы 0,5 % расход жидкости составляет 20 м3, свежего известкового молока 0,15 м3
Аммиачный способ. Газ, содержащий SO2, очищают от пыли и охлаждают до температуры 35-40°С, затем промывают раствором, содержащим (NH4)2SO3. При этом происходит реакция (NH4)2SO3 + SO2 + Н2О ↔2NH4H2SO3, в результате которой газ очищается от SO2.
При нагревании до кипения раствора бисульфита аммония, полученного в результате взаимодействия, описанного выше, реакция пойдет в обратном направлении с выделением диоксида серы и получением раствора сульфита аммония (рис.3).
|
|
|
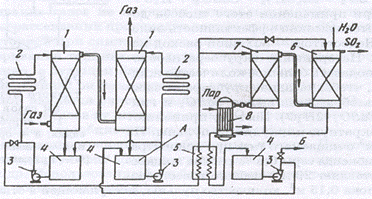 |
Рис.3. Схема обогащения SO2 аммиачно-циклическим методом:
1 — абсорберы; 2 — холодильники; 3 — насосы; 4 — сборники; 5 — теплообменник; 6 — конденсационная колонна; 7 — отгонная колонна; 8 — кипятильник отгонной колонны; А — подача свежего поглотителя; Б — вывод поглотителя из цикла.
Раствор сульфита аммония охлаждают и снова используют для извлечения диоксида серы из газа. Таким образом совершается круговой цикл: абсорбент поглощает SO2, а затем после отгонки этого компонента и охлаждения используетсяповторно. Такой метод называют циклическим.
Загрязнение окружающей среды при авариях. Экологический риск
Экологическая безопасность – возможность существования человека в среде обитания в условиях хозяйственной деятельности природных и технологических катастроф, влияние других факторов, нарушающих приспособленность живых систем к условиям существования.
Наиболее объективной оценкой экологической безопасности является: уровень суммарного риска – вероятности возникновения неблагоприятных, природно-техногенных процессов, сопровождающихся существенными экологическими последствиями.
Экологический риск – это количественная оценка устойчивости компонентов ОС и возможности возникновения необратимых биологических разрушений среды обитания человека.
При оценке экологического риска и возможного ущерба необходимо учитывать производственные, социальные, экономические, медицинские последствия, возникающих не обратимых изменений компонентов ОС.
Для определения экологического риска необходимы:
1. точные данные экологического и инженерного мониторинга, подкрепленные лабораторными исследованиями;
2. развитая информационно-правовая структура;
3. наличие необходимой технической, социально-гигиенической и экономической нормативной базы.
Различают три главные составляющие экологического риска:
1. оценка состояния здоровья человека и возможного числа жертв;
2. оценка состояния биоты по биологическим интегральным показателям;
3. оценка воздействия загрязняющих веществ, техногенных аварий и стихийных бедствий на человека и окружающую природную среду.
В пределах регионов повышенного экологического риска выделяют зоны:
1) хронического загрязнения окружающей среды;
2) повышенной экологической опасности;
3) чрезвычайной экологической ситуации;
4) экологического бедствия.
К зонам чрезвычайной экологической ситуации относят территории, на которых в результате воздействия негативных антропогенных факторов происходят устойчивые отрицательные изменения окружающей среды, угрожающие здоровью населения, состоянию естественных экосистем, генофондам растений и животных.
Нейтрализация сточных вод
Нейтрализация — это химическая реакция, ведущая к уничтожению кислотных свойств раствора с помощью щелочей, а щелочных свойств раствора — с помощью кислот.
Практически нейтральными считаются воды, имеющие pH = 6,5…8,5.
Нейтрализация сточных вод достигается добавкой в сточные воды таких веществ, под влиянием которых наступает нейтрализация содержащихся в них кислот или щелочей и выделение в виде осадка других загрязнений в основном ионов тяжёлых металлов. Применяют следующие способы нейтрализации:
1. взаимную нейтрализацию кислых и щелочных сточных вод
2. нейтрализацию реагентами
3. фильтрование через нейтрализующие материалы (известняк, магнезит, доломит и обожженный магнезит)
Кислые сточные воды травильных отделений нейтрализуются известковым молоком до pH = 8 — 9.
H2SO4 + CaO + H2O -> CaSO4 + 2H2O
Для нейтрализации кислых вод могут быть использованы: NaOH, KOH, Na2CO3, NH4OH (аммиачная вода), CaCO3, MgCO3, доломит (CaCO3⋅MgCO3), цемент. Наиболее доступным реагентом является гидроксид кальция (извест-ковое молоко) с содержанием 5…10% активной извести Ca(OH)2. Иногда для нейтрализации применяют отходы производства: шлаки металлургических производств.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. Различают три вида кислотосодержащих сточных вод:
1) воды, содержащие слабые кислоты (H2CO3, CH3COOH);
2) воды, содержащие сильные кислоты (HCl, HNO3);
3) воды, содержащие серную и сернистую кислоты.
При нейтрализации известковым молоком сточных вод, содержащих серную кислоту, в осадок выпадает гипс CaSO4⋅2H2O, что вызывает отложение его на стенках трубопроводов.
Для нейтрализации любых щелочей применимы серная, соленная, азотная, фосфорная и другие кислоты. Для нейтрализации щелочных сточных вод можно использовать углекислый газ. Для этой цели можно использовать CO2 дымовых газов. Общее уравнение реакции углекислого газа с растворами гидроокисей:
CO2 + OH- = CO32- + H2O
Для нейтрализации щелочных сточных вод используют различные ки-слоты или кислые газы, например, отходящие газы, содержащие CO2, SO2, NO2, N2O3 и др. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить очистку самих газов от вредных компонентов.
Количество кислого газа, необходимого для нейтрализации, может быть определено по уравнению массоотдачи:
М = k⋅ βж⋅ F ⋅ΔС,
где M – количество кислого газа, необходимого для нейтрализации; k – фактор ускорения хемосорбции; βж – коэффициент массоотдачи в жидкой фазе; F – поверхность контакта фаз; ΔС – движущая сила процесса.
Принципиальная схема очистки хромсодержащих сточных вод с начальной концентрацией ионов хрома (VI) до 600 мг/л реагентным методом представлена на рисунке.
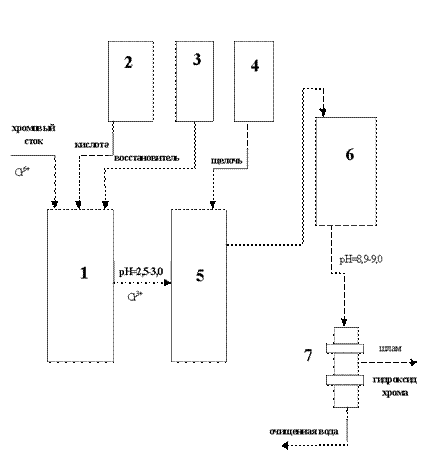
Принципиальная схема очистки хромсодержащих сточных вод реагентным методом: 1 - реактор-накопитель хромовых стоков,
2 -дозатор кислоты, 3 - дозатор восстановителя, 4 - дозатор щелочи, 5 - реактор-нейтрализатор, 6 - отстойник, 7 - механический фильтр.
Дата добавления: 2018-02-18; просмотров: 990; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
