Материальный и энергетический балансы химико-технологических процессов
Основой расчета химико-технологического процесса являются материальный и тепловой (энергетический) балансы.
Под материальным технологическим балансом подразумевается расчет количества использованных (введенных или заданных) веществ, количества полученного продукта, а также побочных веществ. Результаты расчетов выражают в виде графиков, уравнений, таблиц (табл. 2.1) или диаграмм. Количество веществ, введенных в производство, должно равняться количеству полученных веществ. Это вычисляется на основании стехиометрических уравнений, описывающих отдельные стадии производства и побочные процессы.
Материальный баланс отражает закон сохранения массы веществ и может быть представлен уравнением, левую часть которого образует масса исходных веществ ∑mвх, а правую – масса полученных продуктов ∑mвых:
∑mвх = ∑mвых (2.8)
Материальный и энергетический балансы позволяют составить наиболее рациональную схему производства, установить удельное значение выходов продукции, расхода сырья, энергии, определить необходимые размеры аппаратуры, ее экономические показатели, степень совершенства соответствующих процессов. При составлении материальных балансов необходимо знать состав сырья, продуктов и полупродуктов, а иногда их некоторые физико-химические свойства и их изменения в зависимости от внешних условий.
В том случае, когда после расчета количество введенных в процесс веществ не равно количеству полученного продукта и побочных веществ, вычисляют эту разницу, которая называется невязкой баланса. Ее значение также помещают в таблицу материального баланса. Необходимо стремиться, чтобы невязка имела минимальное значение.
Расчеты по материальному балансу составляют на 100 или 1000 кг сырья или готового продукта.
Таблица 2.1
Материальный баланс процесса…
| Задано | Масса | Получено | Масса | ||
| в г | в % | в г | в % | ||
| Количество веществ, введенных в процесс, в аппарат, или в одну из стадий (m1 +m2 + m3 +….) = m | Количество полученных продуктов производства Количество непрореагировавших веществ Количество побочных продуктов реакции Количество потерь Невязка | ||||
| Итого | Итого | ||||
Энергетический баланс обычно составляют по данным материального баланса. Он также рассчитывается на определенное количество сырья или продукта и выражается в тепловых единицах (джоулях), иногда в электрических (киловатт-часах) (табл.2.2).
Таблица 2.2
Энергетический баланс процесса…
| Задано | Получено | ||||
| Статьи баланса | в Дж | в % | Статьи баланса | в Дж | в % |
| 1. Физическая теплота 2. Теплота экзотермических реакций 3. Теплота физических превращений веществ 4. Теплота, введенная извне | 1. Теплота, выведенная из процесса с продуктами реакций 2. Потери теплоты в окружающее пространство 3. Невязка | ||||
| Итого | Итого | ||||
Энергетический баланс выражается уравнением:
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 (2.9)
где: Q1 – теплота, введенная в процесс с исходными веществами, кДж; Q2 – теплота экзотермических реакций, кДж; Q3 – теплота физических превращений веществ, имеющих положительное значение (если же некоторые превращения эндотермические, то значение Q3 берется с отрицательным знаком), кДж; Q4 – теплота, введенная в процесс извне, например, поступающая с горячей водой, нагретыми газами и т.д., кДж; Q5 – теплота, выведенная из процесса с продуктами реакции, кДж; Q6 – потери теплоты в окружающее пространство. кДж.
Q1 рассчитывают по формуле :
Q1 = c∙m∙t (2.10)
где: c – средняя теплоемкость исходных веществ при температуре их поступления в технологический процесс; m – количество исходных веществ, кг, моль и т.д.; t – температура исходных веществ, оС.
Q2 рассчитывается на основании справочных данных или на основании термохимического расчета с использованием закона Гесса; Q3 – на основании справочных данных по теплоте превращения, испарения, возгонки и т.д.; Q4 - аналогично по теплосодержанию газообразного, жидкого или твердого носителя; Q5 – аналогично Q1 и Q4; Q6 – тепловые потери – определяются экспериментально или рассчитываются исходя из существа происходящих процессов.
Например, при определении теплоты, теряемой через стенки аппаратуры (Q), пользуются законом Фурье:
λ
Q = ----- S τ(t1 – t2) (2.11)
b
Согласно этому закону Q (кДж) пропорционально поверхности стенок S (м2), разности температур между поверхностями стенки t1 – t2 (оС), времени τ (с) и обратно пропорционально толщине стенок b (м), λ – коэффициент теплоотдачи, зависящий от материала и температуры стенки (Дж/м∙г∙град).
При расчете потерь за счет теплоизлучения применяют закон Стефана-Больцмана:
Q = S∙ε∙σ∙T4 (2.12)
где: σ – постоянная излучения, равная 5.670400 ∙10-8, Дж∙с-1∙м-2∙К-4; ε – степень черноты (для всех веществ ε <1, для абсолютно черного тела ε =1); S – площадь поверхности тела, м2; Т – абсолютная температура, К.
Невязка как при материальном, так и при энергетическом балансе может иметь положительное и отрицательное значение.
Из результатов энергетического баланса можно определить коэффициент использования энергии – это процентное отношение количества энергии, которое необходимо теоретически затратить на получение массовой или объемной единицы продукта Wm, к количеству практически затраченной энергии Wпр:
Wm
K = ---------- · 100 % (2.13)
Wпр
Пример 1.Составьте материальный баланс процесса нейтрализации азотной кислоты аммиаком на 1 т нитрата аммония (аммиачной селитры). Концентрация азотной кислоты 55 %, газообразного аммиака – 100 %, нитрата аммония – 85 %. Потери аммиака и азотной кислоты – 1 %.
Решение. Нитрат аммония получают по реакции нейтрализации:
NH3 + HNO3 = NH4NO3 + Qp.
Молекулярные массы Mr(NH3)=17, Mr(HNO3)=63, Mr(NH4NO3)=80.
Рассчитываем приход. В соответствии с уравнением реакции на 1 кмоль NH3 образуется 1 кмоль NH4NO3 (100 %):
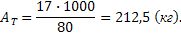
С учётом потерь производства:

Определяем массу азотной кислоты (100 %-ной), необходимой для производства 1 т NH4NO3 (АТ):

Определяем Апр – массу азотной кислоты с учётом потерь производства и концентрации HNO3:

С азотной кислотной поступает вода: 1446.2 – 795.4 = 650.8 (кг)
Общая масса реагентов, поступивших на нейтрализацию: 214.6 + 1446.2 = 1660.8 (кг)
Определяем расход 85 %-ного раствора нитрата аммония, получается: 1000 : 0.85 = 1176.47 (кг)
Потери NH3 составляют: 214.6 – 212.5 = 2.1 (кг)
Потери HNO3 составляют: 795.4 – 787.5 = 7.9 (кг)
Масса испарившейся воды (соковый пар) составляет: 1660. 8 – (1176.47 + 2.1 + 7.9) = 474.33 (кг)
Результаты расчётов сведены в табл. 2.3.
Таблица 2.3
Материальный баланс процесса нейтрализации азотной кислоты аммиаком
| Приход | Расход | ||
| Исходное вещество | m, кг | Продукт | m, кг |
| HNO3 H2O NH3 | 795.4 650.8 214.6 | NH4NO3 (в пересчёте на 100 %) H2O (соковый пар) Потери NH3 Потери HNO3 | 1000.0 176.5 474.3 2.1 7.9 |
| Итого: | 1660.8 | 1660.8 | |
Пример 2.Составьте упрощённый материальный баланс производства этилового спирта прямой гидратацией этилена. Состав исходной парогазовой смеси (в % по объёму): этилен – 60, водяной пар – 40. Степень гидратации этилена – 5 %. Расчёт вести на 1 т этилового спирта. Побочные реакции и давление не учитывать.
Решение. Получение этилового спирта прямой гидратацией этилена осуществляется при температуре 560 К и давлении 80· 105 Па по реакции, протекающей по уравнению
CH2=CH2 + H2O ↔ C2H5OH + Qp
Молекулярные массы: Mr(C2H4)=28; Mr(H20)=18; Mr(C2H5OH)=46.
Приход. Определяем теоретический расход этилена:

Тогда практический расход этилена с учётом степени превращения составит:
 или
или 
Находим объём водяного пара в парогазовой смеси:
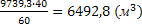 или
или 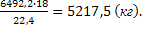
Расход. Определяем, сколько водяного пара израсходовано на гидратацию:

Находим избыток водяного пара (проскок):
 или
или 
Рассчитываем массу непрореагировавшего этилена:
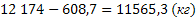 или
или 
Полученные данные сведены в табл. 2.4.
Таблица 2.4
Материальный баланс производства этилового спирта прямой гидратацией этилена
| Приход | Расход | ||||
| Исходное вещество | m, кг | V, м3 | Продукт | m, кг | V, м3 |
| Этилен Водяной пар | 12174.0 5217.5 | 9739.3 6492.8 | Этиловый спирт Непрореагировавший этилен Избыток водяного пара | 1000.0 11565.3 4826.62 | 486.9 9252.3 6005.8 |
| Всего: | 17391.5 | 16231.6 | Всего: | 17391.5 | 15745.0 |
Пример 4.Рассчитайте теплоту, выделяющуюся при образовании 100 кг метилового спирта из СО и Н2. Энтальпия образования (кДж/кмоль) составляет: оксида углерода(II)-110 583; метилового спирта – 201 456.
Решение. Образование метилового спирта из СО и Н2 протекает по реакции, выражаемой уравнением
СО + 2 Н2 ↔ СН3ОН + Qp,
где: Qp – тепловой эффект реакции.
Так как в соответствии с формулой:

где ΔН – энтальпия реакции синтеза метанола, рассчитаем ΔН:

Таким образом: Qp = 90772 кДж/кмоль.
Рассчитаем теплоту, выделяющуюся при образовании 100 кг метилового спирта:

где: 32 – молекулярная масса метилового спирта в кг.
Пример 5.Составьте тепловой баланс реактора синтеза этилового спирта, где протекает реакция: СН2=СН2 + Н2О ↔ С2Н5ОН + 46090, если исходный газ имеет состав (об. %): водяной пар 40 и этилен 60, скорость его подачи в реактор-гидрататор 2000 м3/ч, температура на входе 563 К, а на выходе из реактора 614 К, конверсия за проход этилена 5 %. Теплоёмкость продуктов на входе и выходе одинакова и равна 27.1 кДж/кмоль. Побочные процессы и продукты не учитывать. Потери теплоты в окружающую среду принять 3 % от прихода теплоты.
Решение. Находим состав исходного газа:

Определяем состав газа на выходе из реактора:

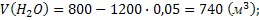

Находим суммарный объём газа (на выходе из реактора):

Тепловой баланс:

Рассчитываем приход теплоты. Физическая теплота газа:

Теплота реакции:
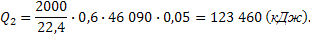
Всего: ΣQприх = 825256,5 (кДж).
Определяем расход теплоты. Теплота, уносимая отходящими газами:


Всего: ΣQрасх = 825100.1 (кДж).
Процесс идёт с небольшим выделением теплоты.
КОНТРОЛЬНЫЕ ВОПРОСЫ К ТЕМЕ 2.2
3-1.Что такое материальный баланс химического производства? Расшифруйте его структуру на примере одного из известных Вам производств.
3-2. Что такое материальный поток и материально-потоковый граф?
3-3. Какие виды энергии и с какой целью используются в химической промышленности?
3-4. Чем характеризуется энергетическая ценность химического топлива?
3-5.Для каких целей используют тепловую энергию в химической промышленности?
ЗАДАЧИ К ТЕМЕ 2.2
3-1. Для получения железа над 130 г нагретого оксида железа(II) было пропущено 31 л оксида углерода(II) (н.у.). Составьте материальный баланс восстановления оксида железа(II).
3-2. Составьте материальный баланс процесса упаривания 100 т раствора NaOH, если первоначальная концентрация его была 15 %-ной, а упаренного раствора 60 %-ной. Потери при упаривании составляют 0.3 %.
3-3. Составьте материальный баланс на получение 1 т карбида кальция, содержащего 90 % СаС2, если сырьё – антрацит марки АК с содержанием 96 % углерода, а известь – 85 % СаО.
3-4. Составьте материальный баланс производства 1000 м3 аммиака, если азотно-водородная смесь получается смешением сырого азота (N2 – 99.6 %, O2 – 0.2 %, Ar – 0.2 %) и сырого водорода (Н2 – 99.6 %, СН4 – 0.2 %, СО – 0.2 %). Синтез ведут под давлением 30.3· 106 Па, при температуре 673 К. Концентрация аммиака в газах после колонны синтеза 18 %, а в циркуляционном газе 4 %, содержание других газов циркуляционном газе 3 %.
3-5. Составьте материальный баланс производства 1 т чистого метилового спирта, если исходная смесь газов состоит только из СО и Н2 в соотношении 1:2, конверсия синтез-газа 20 %. Выход метилового спирта составляет 87 % от теоретического.
3-6. Составьте упрощённый материальный баланс на получение 1 т уксусной кислоты (без учёта побочных реакций), если выход кислоты по реакции: СН3СНО + 0.5 О2 → СН3СООН составляет 96 % (от теоретического), технический ацетальдегид 99 %-ной чистоты и реагирует на 98 %, кислород связывается на 99 %, непрореагировавшего ацетальдегида остаётся 2 %, кислорода 1 % (2 % ацетальдегида расходуется на побочные реакции).
3-7. Определите энтальпию и тепловой эффект химической реакции газификации твёрдого топлива, если из генератора водяного пара выходит газ следующего состава (в % по объёму): СО – 38; Н2 – 50; СО2 – 6,2; N2 – 5,8. Расчёт следует вести на 1000 м3 генераторного газа. Теплота образования (в кДж/моль): СО – 110.58; Н2О (пар) – 242.00; СО2 – 343.79.
3-8. Определите теплоту образования ацетилена, если известно, что при сгорании 1 моль его выделяется 1608.10 кДж теплоты, а теплоты образования воды и углекислого газа составляют соответственно 241.84 кДж/моль и 394.08 кДж/моль.
3-9. Составьте тепловой баланс реактора синтеза метанола, если исходный газ имеет состав (в % по объёму): 20 СО и 80 Н2. Скорость его подачи 80000 м3/ч при температуре на входе в реактор 473 К, а на выходе 573 К. Конверсия СО 35 %. Теплоёмкость газа на входе и на выходе одинакова и равна 32.3 (кДж/моль·К). С помощью холодильника отводится 20240∙103 кДж.
3-10. Рассчитайте Kc реакции образования метилового спирта из формальдегида по уравнению: Н2 + СН2О ↔ СН3ОН, если при температуре 298.1 К и давлении 1.05· 105 Па константа равновесия реакции составляет 2.02· 1013 Па.
3-11. Рассол с концентрацией 20 мас. % в количестве 9500 кг упаривают до концентрации 65 мас. %. Составьте материальный баланс процесса упаривания с учетом производственных потерь 0.2 %.
3-12. Константа равновесия реакции: 2 Н2 + О2 ↔ 2 Н2О при температуре 1500 К равна 7.6· 10-12. Рассчитайте значение Кр этой реакции при температуре 1560 К. Энтальпия реакции ΔН = - 241828.7 Дж/моль.
3-13. Константа равновесия реакции: 2 SO2 + O2 ↔ 2 SO3 при температуре 950 К равна 1.06· 10-2. Определите Кр реакции при температуре 850 К. Энтальпия реакции ΔН= - 92.623 кДж/моль.
3-14. Исходные концентрации азота и водорода в газовой смеси, поступающей на синтез аммиака, равны: 0.01 кмоль/дм3 N2 и 0.03 кмоль/дм3 Н2. Найти Кс и Кр реакции синтеза аммиака при температуре 673 К, если равновесный выход аммиака составляет x = 20 %.
3-15. Константа прямой реакции гидратации этилена, протекающей по уравнению: С2Н4 + Н2О = С2Н5ОН, при температуре 573 К и давлении 80· 105 Па составляет 2.9· 10-8. Определите равновесную степень превращения этилена.
3-16. Какую размерность имеют константы равновесия для следующих реакций:
Fe3+(водн) + SCN-(водн) ↔ [Fe(SCN)]2+(водн); N2O4(г) ↔ 2 NO2(г)?
3-17. При температуре 873 К и давлении 6· 107 Па константа равновесия реакции: Fe3O4(тв) + СO ↔ 3 FeO(тв) + CO2 равна 15. Определите, сколько оксида железа может восстановить в этих условиях 1000 м3 газа, содержащего 1.0 моль/дм3 СО и 0.3 моль/дм3 СО2 при условии равновесия в системе.
3-18. Составьте материальный баланс термического обогащения 100 кг мирабилита, в составе которого, помимо кристаллизационной 6 %-ной гигроскопической воды, в конечном продукте обнаружено 0.4 мас. % влаги.
3-19. Составьте материальный баланс процесса нейтрализации в производстве нитрата аммония. Концентрация исходной азотной кислоты – 50 %, аммиака – 90 %. Получаемый раствор содержит 70 % нитрата аммония.
3-20. Составьте материальный баланс процесса нейтрализации в производстве сульфата аммония. Концентрация исходной серной кислоты – 60 %, аммиака – 100 %. Получаемый раствор содержит 75 % нитрата аммония.
ГЛАВА 3. ХИМИЧЕСКОЕ СЫРЬЕ
Дата добавления: 2018-02-18; просмотров: 10333; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
