Расчеты скоростей и констант скоростей химических реакций
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Сибирская государственная автомобильно-дорожная академия (СибАДИ)»
Кафедра «Инженерная экология и химия»
РАБОЧАЯ ТЕТРАДЬ
по практическому курсу дисциплины
«Физическая химия» для бакалавров
направления 280700.62 «Техносферная безопасность»
Раздел 5 «Химическая кинетика и катализ»
ФИО студента______________________
Группа__________________
Омск, 2012
Содержание
ВВЕДЕНИЕ…………………………………………………….……...….........................................3
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ ПО ТЕМЕ 5.1. ФОРМАЛЬНАЯ КИНЕТИКА…………………..4
5.1.1. Расчеты скоростей и констант скоростей химических реакций…………………………..7
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ ПО ТЕМЕ 5.2. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ…………………………………………………………………………………..14
5.2.1. Расчеты по правилу Вант-Гоффа и уравнению Аррениуса…………...............................16
Задачи для самопроверки…………………….………… ………………......................................19
ЛАБОРАТОРНОЕ ЗАНЯТИЕ ПО ТЕМЕ 5.1. ФОРМАЛЬНАЯ КИНЕТИКА………………...24
Библиографический список………………………………………………………………………31
ПРИЛОЖЕНИЕ. ГЛОССАРИЙ…………………………………………………………………..32
ВВЕДЕНИЕ
В рабочей тетради представлен практический курс 5-го раздела «Химическая кинетика и катализ» дисциплины «Физическая и коллоидная химия». Рабочая тетрадь включает материал для проведения как практических, так и лабораторных занятий. Материал практических занятий по каждой теме изложен в следующей последовательности: краткая теоретическая часть (в виде понятий, законов, уравнений и формул, необходимых для проведения расчетов); условия задач по соответствующим вариантам (всего 20 вариантов); разобранный пример решения типовой задачи с методическими указаниями по ее решению и последовательность решения индивидуальных задач своего варианта. Для закрепления практических навыков проведения кинетических расчетов приводится набор задач для самопроверки. На каждую задачу дан ответ для того, чтобы проконтролировать правильность ее решения.
Материал для проведения лабораторного занятия включает: вопросы к коллоквиуму по теоретической части; изложение цели, методических указаний и порядка проведения лабораторной работы; таблицы для внесения результатов измерений; места, отводимые для построения графических зависимостей, расчетов и выводов.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ ПО ТЕМЕ 5.1.
ФОРМАЛЬНАЯ КИНЕТИКА
Химическая кинетика - раздел физической химии, изучающий скорость и механизм химической реакции, а также зависимость скорости протекания реакции от различных факторов.
Химические реакции протекают с различными скоростями. О скорости химических реакций судят по изменению концентрации реагирующих веществ в единицу времени.
Среднюю скорость химической реакции  в данном промежутки времени находят по формуле
в данном промежутки времени находят по формуле
 ,
,
где 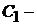 концентрация одного из реагирующих веществ в момент времени τ1;
концентрация одного из реагирующих веществ в момент времени τ1;
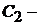 концентрация этого же вещества к моменту времени τ2.
концентрация этого же вещества к моменту времени τ2.
Истинная скорость 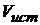 , т.е. скорость реакции в данный момент времени, выражается первой производной по времени
, т.е. скорость реакции в данный момент времени, выражается первой производной по времени
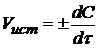 . (1)
. (1)
Основными факторами, влияющими на скорость реакции, являются концентрации реагирующих веществ и температура. Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс:
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Для реакции вида 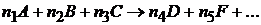 закон действующих масс можно математически записать так:
закон действующих масс можно математически записать так:
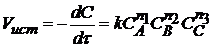 , (2)
, (2)
где  концентрации веществ А, В, С (моль/дм3) в данный момент времени;
концентрации веществ А, В, С (моль/дм3) в данный момент времени; 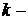 коэффициент пропорциональности, называемый константой скорости реакции.
коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости представляет собой скорость реакции, когда концентрации всех исходных веществ равны 1 моль/ дм3.
По характеру протекания реакции подразделяются на три группы: одномолекулярные, двухмолекулярные и трехмолекулярные. В одномолекулярных реакциях в отдельном акте изменение претерпевает одна молекула вещества. Схематично эти реакции можно записать так:
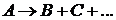
Скорость одномолекулярной реакции пропорциональна наличному числу молекул данного вещества С
 , (3)
, (3)
где 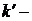 константа скорости одномолекулярной реакции.
константа скорости одномолекулярной реакции.
По закону одномолекулярных реакций протекают многие химические реакции разложения, изомеризации, реакция инверсии тростникового сахара, радиоактивный распад, диффузия газов.
В двухмолекулярных реакциях в отдельном акте изменение претерпевают две одинаковые или две различные молекулы веществ
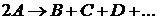
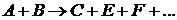
Скорость двухмолекулярной реакции прямо пропорциональна произведению концентраций двух реагирующих веществ (С1 и С2)
 , (4)
, (4)
где  константа скорости двухмолекулярной реакции.
константа скорости двухмолекулярной реакции.
Для частного случая, когда  ,
,
 . (5)
. (5)
Трехмолекулярные реакции, т.е. реакции, в отдельном акте которых участвуют три одинаковые или три различные молекулы, наблюдаются сравнительно редко.
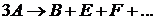

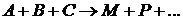
Скорость трехмолекулярных реакций в общем случае прямо пропорциональна произведению концентраций трех реагирующих веществ  и
и 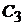 .
.
 , (6)
, (6)
Если 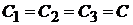 , то
, то
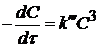 . (7)
. (7)
Реакции, в которых участвуют более трех молекул, протекают ступенчато, по стадиям. Общая скорость таких сложных реакций определяется скоростью (и законом протекания) наиболее медленной из стадий. Реакции бывают первого, второго и третьего порядка. Порядок реакции определяется суммой величин показателей степени 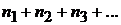 при значениях концентраций веществ
при значениях концентраций веществ  в уравнении химической реакции
в уравнении химической реакции 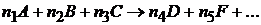
Порядок не всегда совпадает с молекулярностью. Его определяют опытным путем. Особенно это важно для сложных ступенчатых реакций, когда по суммарному уравнению химической реакции совершенно невозможно судить о механизме протекания процесса.
Для вычисления констант скоростей реакций первого, второго и третьего порядка дифференциальные уравнения (3), (4), (5), (6) и (7) интегрируют.
Для реакции первого порядка
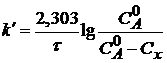 , (8)
, (8)
для реакции второго порядка
 , (9)
, (9)
где 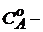 начальная концентрация первого вещества, моль/ дм3;
начальная концентрация первого вещества, моль/ дм3;
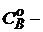 начальная концентрация второго вещества, моль/ дм3;
начальная концентрация второго вещества, моль/ дм3;
 количество молей вещества, вступивших в реакцию к моменту времени τ от начала опыта, моль/ дм3.
количество молей вещества, вступивших в реакцию к моменту времени τ от начала опыта, моль/ дм3.
Если начальные концентрации веществ равны, т.е. 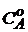 =
= 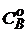 , то интегрирование уравнения (5) приводит к более простому выражению для подсчета константы скорости двухмолекулярной реакции
, то интегрирование уравнения (5) приводит к более простому выражению для подсчета константы скорости двухмолекулярной реакции
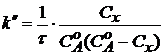 . (10)
. (10)
Расчеты скоростей и констант скоростей химических реакций
Задача 1
Определить скорость реакции взаимодействия веществ А и В в начальный момент и по истечении некоторого времени. Для каждого варианта в табл.1 приведены: уравнение реакции, начальные концентрации веществ А и В, константа скорости реакции, процент уменьшения концентрации вещества А по истечении некоторого времени.
П р и м е р
Реакция между веществами А и В выражается уравнением
2А + В → С.
Начальная концентрация вещества А равна 3,2 моль/ дм3, а вещества В 1,6 моль/ дм3. Константа скорости реакции 0,75. Определить скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация вещества А уменьшилась на 16 %.
Таблица 1
Дата добавления: 2018-02-18; просмотров: 654; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
