Исходные данные для расчетов скоростей реакций
| Вариант | Уравнение химической реакции | Начальная концентрация А, моль/дм3 | Начальная концентрация В, моль/дм3 | Константа скорости реакции | Уменьшение концентрации вещества А на процент, % |
| 1 | 2А + В = С | 5,1 | 1,8 | 0,85 | 16 |
| 2 | 3,7 | 2,7 | 0,78 | 20 | |
| 3 | 4,3 | 2,3 | 0,67 | 10 | |
| 4 | 3,8 | 3,1 | 0,82 | 11 | |
| 5 | 4,9 | 4,0 | 0,71 | 18 | |
| 6 | 5,0 | 3,9 | 0,67 | 15 | |
| 7 | А + В = С | 3,9 | 4,5 | 0,59 | 25 |
| 8 | 4,2 | 2,8 | 0,81 | 22 | |
| 9 | 4,7 | 1,9 | 0,77 | 18 | |
| 10 | 5,6 | 4,8 | 0,66 | 19 | |
| 11 |
| 6,6 | 6,0 | 0,79 | 17 |
| 12 | 6,2 | 3,0 | 0,84 | 14 | |
| 13 | А + 2В = С | 2,9 | 1,7 | 0,83 | 16 |
| 14 | 3,3 | 2,8 | 0,76 | 19 | |
| 15 | 3,8 | 6,1 | 0,61 | 24 | |
| 16 | 5,7 | 7,0 | 0,58 | 23 | |
| 17 | 6,2 | 2,7 | 0,80 | 26 | |
| 18 | 5,1 | 3,1 | 0,69 | 9 | |
| 19 | 2,7 | 1,9 | 0,73 | 12 | |
| 20 | 4,1 | 4,5 | 0,88 | 18 |
Решение примера
Используем уравнение (2) для вычисления скорости реакции в начальный момент
 .
.
По истечении некоторого времени, когда концентрация вещества А уменьшится на 0,5 моль/дм3, концентрация вещества В (в соответствии с уравнением химической реакции) должна уменьшится на 0,25 моль/дм3, т.е.  моль/дм3. Следовательно, скорость реакции станет равной
моль/дм3. Следовательно, скорость реакции станет равной
 .
.
Решение задачи 1
1. Записываем уравнение химической реакции своего варианта.
_____________________________________________________
2. Вычисляем скорость реакции в начальный момент времени
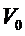 = _______________________________________________
= _______________________________________________
3. Вычисляем концентрацию вещества А по истечению некоторого времени.
|
|
|
 = ___________________________________________________ моль/дм3.
= ___________________________________________________ моль/дм3.
4. Определяем концентрацию вещества В по истечению некоторого времени (в соответствии с уравнением химической реакции).
 = _______________________________________________ моль/дм3.
= _______________________________________________ моль/дм3.
5. Вычисляем скорость реакции по истечении некоторого времени.
 = ___________________________________________________
= ___________________________________________________
Задача 2
Определить, какое время потребуется для разложения определенного количества вещества, выраженного в процентах. Реакция разложения протекает как реакция первого порядка (т.е. по закону одномолекулярных реакций). Период полураспада и процент разложения вещества для каждого варианта приведены в табл. 2.
Таблица 2
Исходные данные для расчетов времени реакции
| Вариант | Период
полураспада,
 , мин -1 , мин -1
| Процент разложения вещества, % | Вариант | Период
полураспада,
 , мин -1 , мин -1
| Процент разложения вещества, % | ||
| 1 | 15,86 | 99 | 11 | 20,99 | 78 | ||
| 2 | 10,44 | 80 | 12 | 15,48 | 82 | ||
| 3 | 20,03 | 87 | 13 | 17,87 | 97 | ||
| 4 | 13,20 | 92 | 14 | 18,29 | 96 | ||
| 5 | 10,80 | 95 | 15 | 19,47 | 98 | ||
| 6 | 19,50 | 88 | 16 | 19,13 | 83 | ||
| 7 | 18, | 79 | 17 | 18,01 | 78 | ||
| 8 | 16,77 | 88 | 18 | 18,17 | 92 | ||
| 9 | 17,24 | 91 | 19 | 16,23 | 90 | ||
| 10 | 18,11 | 85 | 20 | 15,39 | 80 | ||
П р и м е р
|
|
|
Реакция разложения перекиси водорода в водном растворе протекает как реакция первого порядка. Период полураспада при данном условии равен 15,86 мин. Определить, какое время потребуется для разложения (при заданных условиях) 99 % перекиси водорода.
Решение примера
По величине периода полураспада вычисляем константу скорости разложения перекиси водорода. Периодом полураспада (  ) называется время, в течение которого распадается половина взятого вещества. При этом
) называется время, в течение которого распадается половина взятого вещества. При этом
 ,
,
где  - начальная концентрация вещества.
- начальная концентрация вещества.
Используем уравнение константы скорости реакции первого порядка (8) для частного случая, когда время  ,
,
 мин-1.
мин-1.
Зная константу, определяем время, за которое разложится 99 % перекиси водорода,
 ;
;  ;
;
 .
.
Решение задачи 2
1. Вычисляем константу скорости разложения вещества.
 = ___________________________________________________
= ___________________________________________________
2. Определяем время, за которое разложится указанный процент вещества.

 = ____________________________________________________________
= ____________________________________________________________
Задача 3
Вычислить время (мин.), необходимое для омыления определенного процента эфира. Объемы и нормальные концентрации (молярные концентрации эквивалента) растворов эфира и гидроксида натрия, а также константа скорости и процент омыления эфира для каждого варианта приведены в табл. 3.
|
|
|
Таблица 3
Дата добавления: 2018-02-18; просмотров: 1538; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
