Линейный гармонический осциллятор. Туннельный эффект.
Линейным гармоническим осциллятором называется система, потенциальная энергия которой квадратично зависит от координаты: 
Здесь m — масса частицы, а ω — собственная частота осциллятора.

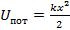 Тунельный эффект.
Тунельный эффект.
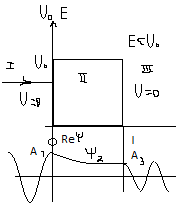

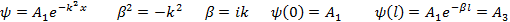
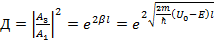 – для прямоугольного барьера
– для прямоугольного барьера
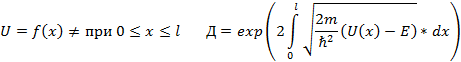
Тунельный эффект- это проникновение частицы под потенциальный барьер (высота которого больше полной энергии частицы).
Над барьерное отражение – это отражение частицы от потенциального барьера, высота которого меньше полной энергии частицы.
 Квантовая частица с не нулевой вероятностью от барьера отразится.
Квантовая частица с не нулевой вероятностью от барьера отразится.
17. Строение атома. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель, ее трудности. Закономерности в атомных спектрах. Теория атома водорода по Бору. Спектр водорода.
В 1903 году Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри которой находятся электроны. Атом в целом нейтрален: суммарный заряд сферы равен заряду электронов, однако спектр такого атома должен был быть сложным, но никоим образом не линейчатым, что противоречило экспериментам. Модель атома, состояла из сферы, в центре которой находилось положительно заряженное ядро, а вокруг него располагались электроны. Эта модель также не вписывалась в эксперименты. Наиболее известна в то время была планетарная модель атома, предложенная Э. Резерфордом.
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов: диаметр атома - величина порядка 10 см, а диаметр ядра - порядка 10 - 10 см.
|
|
|
|
|
|
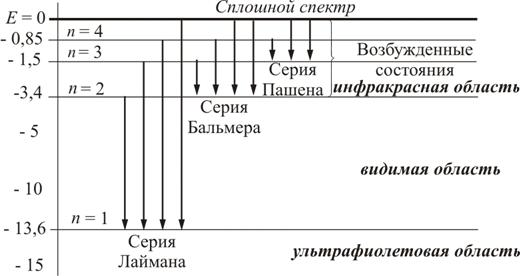
Постулаты Бора.
1.Стационарное состояние.
Электрон в атоме может находится только на стационарной орбите при этом не излучает и не поглощает.
Условие стационарной орбиты: 
2.Правило частот. Закон сохранения энергии.
Атом излучает или поглощает энергию только при переходе с одной орбиты на другую, при этом энергия излученная или поглощенная фотоном равна разности энергий стационарных состояний между которыми произошел переход. 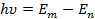
Спектр испускания атома водорода - оптический спектр, описываемый формулой Бальмера, которая связывает частоту излучения и пару главных квантовых чисел.
В зависимости от значений главных квантовых чисел в спектре выделяют:
-1- спектральную серию Лаймана линий далекого ультрафиолетового участка спектра;
-2- спектральную серию Бальмера линий видимого и близкого ультрафиолетового участка спектра;
-3- спектральную серию Пашена линий инфракрасного участка спектра.
-4- спектральную серию Брэкета линий инфракрасного участка спектра;
-5- спектральную серию Пфунда линий инфракрасного участка спектра.
|
|
|
18. Атом водорода в квантовой механике. Квантовые числа. Многоэлектронные атомы. Спектры атомов.
Водородный атом является атомом химического элемента водорода. Он состоит из положительно заряженного протона, который является ядром водородного атома и единственного отрицательно заряженного электрона. В общем случае, атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Часто в квантовой механике рассматривается электрон в электростатическом поле атомного ядра. В этом случае, электрон описывается редуцированной одночастичной матрицей плотности или волновой функцией. Из-за своей простоты атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике поскольку соответствующие уравнения допускают точное или приближенное аналитическое решения.
Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
|
|
|
Некоторые квантовые числа связаны с движением в пространстве и характеризуют пространственное распределение волновой функции частицы. Это, например, радиальное (главное) (nr), орбитальное (l) и магнитное (m) квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента и его проекция на заданную ось, соответственно.
Третьим источником для квантовой теории послужили оптические спектры атомов. Ещё в начале XIX в. физики обнаружили, что при нагревании любое вещество излучает свет строго определённых длин волн. Разлагая такой свет с помощью спектроскопа, получают ряды спектральных линий - линейчатые спектры, индивидуальные для каждого элемента, входящего в это вещество.
В 1859 г. Густав Роберт Кирхгоф и Роберт Бунзен разработали метод спектрального анализа. Было установлено, что при нагревании атомы испускают световые волны характерной длины независимо от того, в составе какого вещества эти атомы находятся.
К началу XX в. был накоплен огромный спектроскопический материал. Но как его объяснить? Ведь согласно электродинамике, излучение происходит при неравномерном движении зарядов. Какие же движения зарядов в атоме вызывают излучение? Как должен быть устроен атом, чтобы его излучение имело наблюдаемый спектр?
В 1911 г. Эрнест Резерфорд, исследуя рассеяние а-частиц на золотой фольге, обнаружил, что они отклоняются от первоначального направления на разные углы, а некоторые из них отклоняются на углы, большие 90 градусов, как будто на их пути встречался большой положительный заряд, сконцентрированный в очень малой области пространства. Резерфорд предположил, что атом похож на планетарную систему: положительный заряд сосредоточен в центре, а вокруг вращаются электроны. На основании модели он вывел закон рассеяния а-частиц атомами различных элементов - знаменитую формулу Резерфорда, которая полностью совпала с экспериментальными данными.
Спустя два года, в 1913 г., Нильс Бор, исходя из планетарной модели атома Резерфорда, попытался объяснить атомные спектры. Главная трудность состояла в том, что в соответствии с законами электродинамики электрон, вращаясь вокруг положительно заряженного ядра, должен был за триллионные доли секунды потерять энергию вращения и упасть на ядро, чем всё и закончилось бы. Бор допустил, что электрон в атоме может находиться только на определённых - так называемых стационарных уровнях, или оболочках, где излучения не происходит. Но при переходе электрона с орбиты, на которой он имеет высокую энергию, на другую, с более низкой энергией, излучается фотон.
Дата добавления: 2018-02-18; просмотров: 808; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
