Составить схему электрохимической коррозии при контакте двух металлов и рассчитать ЭДС коррозии (реакция среды и тип деполяризации указаны в задании)
Пример. Дана схема окислительно-восстановительной реакции. Находим степени окисления химических элементов, изменившиеся в ходе реакции и указываем их на схеме:

Для серы:  ; для марганца:
; для марганца:  .
.
Последний переход происходит в кислой среде, поэтому добавляем ионы Н+:
 .
.
В кислой среде возможный продукт в правой части уравнения - молекулы воды:
 .
.
Уравнивая, получаем полуреакцию:
 .
.
Находим стандартные электрохимические потенциалы полуреакций и даем им характеристику в таблице:

| ||||
| *2 | 
| 1,51 | Реакция восстановления | Окислитель |
| *5 | 
| -0,48 | Реакция Окисления | Восстанови- тель |
Складываем данные уравнения, умножая их на 2, или 5, соответственно, исходя из баланса электронов и получаем сокращенное ионное уравнение процесса:
 .
.
Переходим к молекулярному уравнению, указываем переход электронов:



 10е
10е
Возможное направление протекания реакции - прямое, т.к.  >
> 
Подтверждаем это термодинамическими расчетами:
 1,51 - (-0,48) = 1,99 В.
1,51 - (-0,48) = 1,99 В.

Т.к.  >0,
>0,  <0, то реакция протекает в прямом направлении.
<0, то реакция протекает в прямом направлении.
Пример. Даны два металла (Ni, Zn), находящиеся в растворах их солей. Для составления схемы гальванического элемента находим их стандартные электродные потенциалы:

Составляем схему гальванического элемента:
(-) Zn | ZnSO4 ||NiSO4 | Ni (+)
(-) Анод, окисление: 
(+) Катод, восстановление: 
Проводим термодинамические расчеты:
 >0.
>0.
 < 0.
< 0.
Пример. Составить схемы электролиза и выполнить расчеты по следующим данным: 
Р е ш е н и е
Водный раствор (растворимый анод):


 <7.
<7.
(-) (+)
катод анод



Водный раствор (нерастворимый анод):
Ni(NO3)2
Катод Анод



 O2+ +4
O2+ +4  .
.

Расплав (растворимый анод):

(-) (+)
катод анод (растворимый)


Расчет массы выделившегося на катоде металла:

Пример. Написать в общем виде выражение  для образования оксида металла при химической коррозии . Дано: оксид Fe2O3.
для образования оксида металла при химической коррозии . Дано: оксид Fe2O3.
Р е ш е н и е
При химической коррозии железа протекает следующая реакция:

По изотерме Вант-Гоффа выражение изменения энергии Гиббса для этой реакции имеет вид:

где: 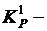 константа равновесия при температуре "Т";
константа равновесия при температуре "Т";

Химическая коррозия возможна, если  <0, или
<0, или  >
> 
Пример. Составить схему электрохимической коррозии при контакте двух металлов - Cu, Zn в кислой среде с водородной деполяризацией и рассчитать ЭДС коррозии.
Р е ш е н и е
Для анализа процесса пользуемся табличными данными (Приложение 2, табл.3-4).
Zn Cu




Анодная реакция: Катодная реакция:


 или:
или: 


 >0 , т.е. коррозия возможна.
>0 , т.е. коррозия возможна.
Pаспределение задания по вариантам
| № вари-анта | Номера данных в приложении. | ||||||||||
| П.1 | П.2 | П.3 | П.4 | П.5 | П.6 | П.7 | П.8 | П.9 | П.10 | П.11 | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 01 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 02 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| 03 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 |
| 04 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 |
| 05 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 |
| 06 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 |
| 07 | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
| 08 | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 |
| 09 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 | 9 |
| 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 |
| 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 |
| 13 | 13 | 13 | 13 | 13 | 13 | 13 | 13 | 13 | 13 | 13 | 13 |
| 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 |
| 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 |
| 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 |
| 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 |
| 18 | 18 | 18 | 18 | 18 | 18 | 18 | 18 | 18 | 18 | 18 | 18 |
| 19 | 19 | 19 | 19 | 19 | 19 | 19 | 19 | 19 | 19 | 19 | 19 |
| 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| 21 | 21 | 21 | 21 | 21 | 21 | 21 | 21 | 21 | 21 | 21 | 21 |
| 22 | 22 | 22 | 22 | 22 | 22 | 22 | 22 | 22 | 22 | 22 | 22 |
| 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 |
| 24 | 24 | 24 | 24 | 24 | 24 | 24 | 24 | 24 | 24 | 24 | 24 |
| 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 |
| 26 | 24 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 1 | 1 |
| 27 | 23 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 2 | 2 |
| 28 | 22 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 3 | 3 |
| 29 | 21 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 4 | 4 |
| 30 | 20 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 5 | 5 |
| 31 | 19 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 6 | 6 |
| 32 | 18 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 7 | 7 |
| 33 | 17 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 8 | 8 |
| 34 | 16 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 9 | 9 |
| 35 | 15 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 10 | 10 |
| 36 | 14 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 11 | 11 |
| 37 | 13 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 12 | 12 |
| 38 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 13 | 13 |
| 39 | 11 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 14 | 14 |
| 40 | 10 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 15 | 15 |
| 41 | 9 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 16 | 16 |
| 42 | 8 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 17 | 17 |
| 43 | 7 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 19 | 20 |
| 44 | 6 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 1 | 20 | 19 |
| 45 | 5 | 20 | 21 | 22 | 23 | 24 | 25 | 1 | 2 | 21 | 21 |
| 46 | 4 | 21 | 22 | 23 | 24 | 25 | 1 | 2 | 3 | 22 | 22 |
| 47 | 3 | 22 | 23 | 24 | 25 | 1 | 2 | 3 | 4 | 23 | 23 |
| 48 | 2 | 23 | 24 | 25 | 1 | 2 | 3 | 4 | 5 | 25 | 25 |
| 49 | 1 | 24 | 25 | 1 | 2 | 3 | 4 | 5 | 6 | 1 | 1 |
| 50 | 25 | 22 | 15 | 17 | 16 | 21 | 13 | 14 | 2 | 2 | 25 |
| 51 | 23 | 20 | 13 | 19 | 15 | 23 | 14 | 13 | 3 | 3 | 24 |
| 52 | 21 | 18 | 11 | 21 | 14 | 25 | 15 | 12 | 4 | 4 | 23 |
| 53 | 19 | 16 | 9 | 23 | 13 | 24 | 16 | 11 | 5 | 5 | 22 |
| 54 | 17 | 14 | 7 | 24 | 12 | 22 | 17 | 10 | 6 | 6 | 21 |
| 55 | 15 | 12 | 5 | 25 | 11 | 20 | 18 | 9 | 7 | 7 | 20 |
| 56 | 13 | 10 | 3 | 22 | 10 | 18 | 19 | 8 | 8 | 8 | 19 |
| 57 | 11 | 8 | 1 | 18 | 9 | 17 | 20 | 7 | 9 | 9 | 18 |
| 58 | 9 | 6 | 2 | 16 | 8 | 16 | 22 | 6 | 10 | 10 | 17 |
| 59 | 7 | 4 | 6 | 14 | 7 | 15 | 24 | 5 | 11 | 1 | 16 |
| 60 | 5 | 2 | 8 | 12 | 6 | 14 | 25 | 4 | 12 | 25 | 15 |
| 61 | 3 | 1 | 10 | 10 | 5 | 12 | 23 | 3 | 13 | 24 | 14 |
| 62 | 1 | 3 | 12 | 8 | 4 | 10 | 19 | 2 | 14 | 23 | 13 |
| 63 | 2 | 5 | 14 | 6 | 3 | 8 | 21 | 1 | 15 | 22 | 12 |
| 64 | 4 | 7 | 16 | 4 | 2 | 6 | 17 | 16 | 16 | 21 | 11 |
| 65 | 6 | 9 | 18 | 2 | 1 | 4 | 15 | 17 | 17 | 20 | 10 |
| 66 | 8 | 11 | 20 | 1 | 3 | 2 | 13 | 18 | 18 | 19 | 9 |
| 67 | 10 | 13 | 22 | 3 | 5 | 1 | 11 | 19 | 19 | 17 | 7 |
| 68 | 12 | 15 | 24 | 5 | 7 | 3 | 9 | 20 | 20 | 16 | 6 |
| 69 | 14 | 17 | 25 | 7 | 9 | 5 | 7 | 21 | 21 | 15 | 5 |
| 70 | 16 | 19 | 23 | 9 | 11 | 7 | 5 | 22 | 22 | 14 | 4 |
| 71 | 18 | 21 | 21 | 11 | 13 | 9 | 3 | 23 | 23 | 13 | 3 |
| 72 | 20 | 23 | 19 | 13 | 15 | 10 | 1 | 24 | 24 | 12 | 2 |
| 73 | 22 | 19 | 17 | 15 | 17 | 11 | 2 | 25 | 25 | 11 | 1 |
| 74 | 24 | 17 | 15 | 17 | 19 | 12 | 3 | 1 | 2 | 2 | 18 |
| 75 | 3 | 5 | 7 | 9 | 11 | 13 | 15 | 17 | 19 | 3 | 17 |
| 76 | 21 | 23 | 25 | 24 | 23 | 22 | 21 | 20 | 19 | 4 | 16 |
| 77 | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 5 | 15 |
| 78 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 6 | 14 |
| 79 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 7 | 13 |
| 80 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 8 | 12 |
| 81 | 20 | 21 | 22 | 23 | 24 | 25 | 1 | 2 | 3 | 9 | 11 |
| 82 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 10 | 10 |
| 83 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 11 | 9 |
| 84 | 22 | 23 | 24 | 25 | 23 | 21 | 19 | 17 | 15 | 12 | 8 |
| 85 | 13 | 11 | 9 | 7 | 5 | 3 | 1 | 2 | 4 | 13 | 7 |
| 86 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 | 22 | 14 | 6 |
| 87 | 24 | 25 | 23 | 21 | 19 | 17 | 15 | 13 | 11 | 15 | 5 |
| 88 | 9 | 7 | 5 | 3 | 1 | 2 | 4 | 6 | 8 | 16 | 4 |
| 89 | 10 | 12 | 14 | 16 | 18 | 20 | 22 | 24 | 25 | 17 | 3 |
| 90 | 23 | 21 | 17 | 13 | 9 | 5 | 1 | 2 | 3 | 18 | 2 |
| 91 | 7 | 11 | 16 | 21 | 25 | 20 | 15 | 10 | 5 | 19 | 19 |
| 92 | 1 | 7 | 13 | 19 | 24 | 23 | 22 | 21 | 20 | 20 | 20 |
| 93 | 25 | 17 | 16 | 18 | 20 | 22 | 23 | 16 | 24 | 21 | 21 |
| 94 | 20 | 11 | 10 | 11 | 10 | 11 | 15 | 17 | 20 | 22 | 22 |
| 95 | 15 | 3 | 6 | 17 | 12 | 13 | 17 | 20 | 16 | 23 | 23 |
| 96 | 10 | 5 | 2 | 20 | 14 | 15 | 19 | 21 | 12 | 24 | 24 |
| 97 | 5 | 13 | 3 | 22 | 16 | 17 | 21 | 23 | 10 | 25 | 25 |
| 98 | 1 | 18 | 11 | 21 | 18 | 19 | 23 | 24 | 8 | 3 | 1 |
| 99 | 6 | 25 | 19 | 24 | 20 | 21 | 25 | 21 | 6 | 2 | 2 |
| 100 | 12 | 21 | 22 | 23 | 11 | 23 | 13 | 16 | 4 | 1 | 3 |
| № вар | П1 | П2 | П3 | П4 | П5 | П6 | П7 | П8 | П9 | П10 | П11 |
| 101 | 25 | 1 | 14 | 22 | 16 | 21 | 9 | 2 | 23 | 3 | 4 |
| 102 | 24 | 2 | 13 | 21 | 17 | 22 | 10 | 3 | 24 | 2 | 5 |
| 103 | 23 | 3 | 12 | 20 | 18 | 23 | 11 | 4 | 25 | 1 | 6 |
| 104 | 22 | 4 | 22 | 19 | 19 | 24 | 1 | 5 | 22 | 6 | 7 |
| 105 | 21 | 5 | 21 | 18 | 20 | 25 | 2 | 6 | 21 | 5 | 8 |
| 106 | 20 | 6 | 20 | 17 | 21 | 1 | 3 | 7 | 20 | 4 | 12 |
| 107 | 19 | 7 | 19 | 16 | 22 | 2 | 4 | 8 | 19 | 7 | 11 |
| 108 | 18 | 8 | 18 | 15 | 23 | 3 | 5 | 9 | 18 | 8 | 10 |
| 109 | 17 | 9 | 23 | 14 | 24 | 4 | 6 | 10 | 12 | 9 | 9 |
| 110 | 16 | 10 | 24 | 13 | 25 | 5 | 7 | 11 | 13 | 10 | 17 |
| 111 | 15 | 11 | 25 | 12 | 1 | 6 | 8 | 12 | 14 | 17 | 16 |
| 112 | 14 | 12 | 15 | 11 | 2 | 7 | 12 | 22 | 15 | 16 | 15 |
| 113 | 13 | 13 | 16 | 10 | 3 | 8 | 13 | 23 | 16 | 15 | 14 |
| 114 | 12 | 14 | 17 | 9 | 4 | 9 | 14 | 24 | 17 | 14 | 13 |
| 115 | 11 | 15 | 11 | 8 | 5 | 10 | 15 | 25 | 1 | 13 | 24 |
| 116 | 10 | 16 | 10 | 7 | 6 | 11 | 16 | 21 | 2 | 12 | 23 |
| 117 | 9 | 17 | 9 | 6 | 7 | 12 | 17 | 20 | 3 | 11 | 22 |
| 118 | 8 | 18 | 8 | 5 | 8 | 13 | 18 | 19 | 4 | 21 | 21 |
| 119 | 7 | 19 | 7 | 4 | 9 | 14 | 19 | 18 | 5 | 22 | 20 |
| 120 | 6 | 20 | 1 | 3 | 10 | 15 | 20 | 17 | 6 | 23 | 19 |
| 121 | 5 | 21 | 3 | 2 | 11 | 16 | 21 | 16 | 7 | 24 | 18 |
| 122 | 4 | 22 | 4 | 1 | 12 | 17 | 22 | 15 | 8 | 25 | 1 |
| 123 | 3 | 23 | 5 | 25 | 13 | 18 | 25 | 14 | 9 | 20 | 2 |
| 124 | 2 | 24 | 6 | 24 | 14 | 19 | 24 | 13 | 10 | 19 | 25 |
| 125 | 1 | 25 | 2 | 23 | 15 | 20 | 23 | 1 | 11 | 18 | 3 |
| 126 | 12 | 6 | 11 | 23 | 3 | 20 | 21 | 6 | 9 | 14 | 23 |
| 127 | 11 | 7 | 12 | 21 | 2 | 19 | 22 | 5 | 8 | 15 | 22 |
| 128 | 10 | 8 | 13 | 22 | 1 | 18 | 25 | 4 | 7 | 16 | 24 |
| 129 | 9 | 9 | 14 | 24 | 6 | 17 | 24 | 3 | 6 | 17 | 25 |
| 130 | 8 | 10 | 15 | 25 | 5 | 16 | 23 | 2 | 5 | 8 | 17 |
| 131 | 7 | 11 | 16 | 15 | 4 | 1 | 17 | 1 | 4 | 9 | 18 |
| 132 | 4 | 12 | 17 | 16 | 11 | 2 | 18 | 7 | 3 | 10 | 19 |
| 133 | 3 | 13 | 18 | 17 | 10 | 3 | 19 | 8 | 2 | 11 | 20 |
| 134 | 2 | 14 | 1 | 18 | 9 | 4 | 20 | 9 | 1 | 12 | 21 |
| 135 | 1 | 15 | 2 | 19 | 8 | 5 | 14 | 10 | 15 | 13 | 9 |
| 136 | 5 | 16 | 3 | 20 | 7 | 6 | 15 | 11 | 14 | 1 | 10 |
| 137 | 6 | 17 | 4 | 9 | 14 | 7 | 16 | 12 | 13 | 2 | 11 |
| 138 | 13 | 18 | 5 | 10 | 13 | 8 | 9 | 13 | 12 | 3 | 12 |
| 139 | 14 | 19 | 6 | 11 | 12 | 9 | 10 | 14 | 11 | 4 | 13 |
| 140 | 15 | 20 | 7 | 12 | 15 | 10 | 11 | 18 | 10 | 5 | 14 |
| 141 | 20 | 25 | 8 | 13 | 16 | 11 | 12 | 17 | 25 | 6 | 15 |
| 142 | 19 | 24 | 9 | 14 | 24 | 12 | 13 | 16 | 24 | 7 | 16 |
| 143 | 18 | 23 | 10 | 1 | 25 | 13 | 3 | 15 | 23 | 24 | 4 |
| 144 | 17 | 22 | 21 | 2 | 23 | 14 | 4 | 19 | 22 | 25 | 5 |
| 145 | 16 | 21 | 22 | 3 | 22 | 15 | 5 | 20 | 21 | 23 | 6 |
| 146 | 25 | 5 | 23 | 4 | 21 | 25 | 6 | 23 | 20 | 22 | 7 |
| 147 | 23 | 4 | 24 | 5 | 20 | 24 | 7 | 22 | 19 | 21 | 8 |
| 148 | 22 | 3 | 25 | 6 | 19 | 21 | 8 | 21 | 18 | 20 | 1 |
| 149 | 21 | 2 | 20 | 7 | 18 | 22 | 1 | 25 | 17 | 19 | 2 |
| 150 | 24 | 1 | 19 | 8 | 17 | 23 | 2 | 24 | 16 | 18 | 3 |
| 151 | 4 | 5 | 21 | 4 | 3 | 11 | 4 | 4 | 17 | 18 | 10 |
| 152 | 3 | 4 | 20 | 5 | 2 | 12 | 5 | 5 | 18 | 19 | 11 |
| 153 | 2 | 3 | 19 | 6 | 1 | 13 | 6 | 6 | 19 | 20 | 15 |
| 154 | 1 | 2 | 18 | 3 | 7 | 14 | 7 | 7 | 22 | 21 | 14 |
| 155 | 5 | 1 | 24 | 2 | 6 | 15 | 8 | 8 | 20 | 22 | 13 |
| 156 | 6 | 10 | 25 | 1 | 5 | 16 | 1 | 9 | 21 | 23 | 12 |
| 157 | 7 | 9 | 23 | 12 | 4 | 17 | 2 | 10 | 23 | 24 | 1 |
| 158 | 8 | 8 | 22 | 11 | 15 | 18 | 3 | 17 | 24 | 25 | 2 |
| 159 | 9 | 7 | 13 | 10 | 14 | 19 | 9 | 18 | 25 | 1 | 3 |
| 160 | 17 | 6 | 14 | 9 | 13 | 20 | 15 | 16 | 11 | 2 | 4 |
| 161 | 16 | 15 | 15 | 8 | 12 | 21 | 14 | 15 | 12 | 3 | 9 |
| 162 | 15 | 14 | 16 | 7 | 11 | 22 | 13 | 14 | 13 | 4 | 8 |
| 163 | 18 | 13 | 17 | 15 | 10 | 25 | 12 | 13 | 14 | 5 | 7 |
| 164 | 19 | 12 | 12 | 14 | 9 | 24 | 11 | 12 | 15 | 6 | 6 |
| 165 | 20 | 11 | 11 | 13 | 8 | 23 | 10 | 11 | 16 | 7 | 5 |
| 166 | 10 | 16 | 10 | 21 | 24 | 10 | 16 | 19 | 8 | 8 | 23 |
| 167 | 11 | 17 | 7 | 22 | 25 | 9 | 17 | 20 | 7 | 9 | 19 |
| 168 | 12 | 22 | 8 | 23 | 21 | 8 | 18 | 21 | 6 | 10 | 18 |
| 169 | 13 | 23 | 9 | 24 | 22 | 7 | 19 | 22 | 5 | 15 | 17 |
| 170 | 14 | 24 | 1 | 25 | 23 | 6 | 20 | 23 | 4 | 16 | 16 |
| 171 | 21 | 25 | 2 | 20 | 18 | 5 | 25 | 24 | 3 | 17 | 20 |
| 172 | 22 | 21 | 3 | 19 | 19 | 4 | 24 | 25 | 2 | 14 | 22 |
| 173 | 23 | 20 | 4 | 18 | 20 | 3 | 23 | 1 | 1 | 13 | 25 |
| 174 | 25 | 19 | 6 | 17 | 17 | 2 | 22 | 2 | 10 | 12 | 24 |
| 175 | 24 | 18 | 5 | 16 | 16 | 1 | 21 | 3 | 9 | 11 | 21 |
Приложение 1.
Материалы к контрольному заданию
Таблица1
| Номер варианта | Символы химических элементов | |||
| 1 | Li | B | Sc | Cl |
| 2 | Be | C | Y | Pr |
| 3 | Na | N | La | Nd |
| 4 | Mg | O | Ti | Pm |
| 5 | K | F | V | Sm |
| 6 | Ca | Al | Cr | Eu |
| 7 | Rb | Si | Mn | Gd |
| 8 | Sr | P | Fe | Tb |
| 9 | Cs | S | Co | Dy |
| 10 | Ba | Cl | Ni | Ho |
| 11 | Fr | Ga | Cu | Er |
| 12 | Ra | Ge | Zn | Tm |
| 13 | Na | As | Zr | Yb |
| 14 | Li | Se | Nb | Lu |
| 15 | Be | Br | Mo | Th |
| 16 | Mg | Sn | Tc | Pa |
| 17 | K | Sb | Ru | U |
| 18 | Ca | Te | Rh | Np |
| 19 | Sr | I | Pd | Pu |
| 20 | Cs | I n | Ag | Am |
| 21 | Ba | Tl | Cd | Cm |
| 22 | Fr | Pb | Hf | Bk |
| 23 | Na | Bi | Ta | Cf |
| 24 | Be | Po | W | Es |
| 25 | Sr | As | Re | Fm |
Таблица 2
| Номер варианта | Формулы молекул |
| 1 | NF3 O2 |
| 2 | OF2 N2 |
| 3 | PBr3 CaCl2 |
| 4 | AsCl3 CdF2 |
| 5 | CaBr2 SbCl3 |
| 6 | CdCl2 H2S |
| 7 | GeF4 H2Se |
| 8 | CuCl2 GeCl4 |
| 9 | HgCl2 SiH4 |
| 10 | SnCl2 SiCl4 |
| 11 | PbBr2 H2Te |
| 12 | HgF2 SCl2 |
| 13 | PbF2 CO2 |
| 14 | SF2 AlH3 |
| 15 | GaBr2 PbCl2 |
| 16 | SbBr3 AlCl3 |
| 17 | C2H2 SbF3 |
| 18 | GaBr3 SnF2 |
| 19 | SnBr4 MgCl2 |
| 20 | MgBr2 COCl2 |
| 21 | SnCl4 ZnBr2 |
| 22 | ZnCl2 AsBr3 |
| 23 | SrBr2 PbBr4 |
| 24 | ZnF2 SiF4 |
| 25 | CuF2 PbCl4 |
Таблица 2а
| Номер варианта | Формулы комплексных соединений |
| 1 | K 2 [PtCl6] , K 2 [Cu(CN)4] , Na4 [NiF6] |
| 2 | K 3 [CoF6] , (NH4) 3 [RhCl6] , K 2 [PtCl6] |
| 3 | K 2 [CdI4] , K 2 [NiCl4 ] , [Pt(NH3)]Cl4 |
| 4 | Na3 [AlF6] , K 2 [HgI4] , K 3 [Cr(CN)6] |
| 5 | [Ni(NH3 )6]Cl2 , K[Ag(NO2)2] , Na[Ag(NO3)2] |
| 6 | K4 [Fe(CN)6] , [Zn(NH3)4] Cl2, Na 3 [V(SCN)6] |
| 7 | K3 [Cu(CN)4] , [Ag(NH3)2]NO2, [Ti(H2O)6]Cl3 |
| 8 | K2 [Cd(CN)4] , [Cr(NH3)6]Cl3, [Ti(H2O)6]Br3 |
| 9 | Na3[Co(C2O4)3] , Na2[Ni(CN)4] , K4[CoF6] |
| 10 | Ca3[Co(S2O3)3]2 , [Co(NH3)6]Cl3 , Ni(NH3)6](NO3)2 |
| 11 | [Pt(NH3)6Cl4 , Na2[IrCl6] , Ca3[Co(S2O3)3] 2 |
| 12 | (NH4)3[RhCl6 ] , Na2[IrCl6] , [Co(NH3)6]Cl 2 |
| 13 | [(Ag(NH3)2]NO3 , K[Ag(CN)2] , [Co(H2O)6]Cl 2 |
| 14 | [Co(H2O)6]Cl3 , K2[CdI4] , [Cd(NH3)6]Cl 2 |
| 15 | K2[Ni(CN)]4, Na4[FeF6] , [Cu(NH3)4]Cl 2 |
| 16 | K4[NiF6] , K2[NiCl4] , [Ag(NH3)2]Cl |
| 17 | [Co(H2O)6] Cl 2, K2[CuCl4] , Na3[AlF6] |
| 18 | [Cr(H2O)6] Br 3, K4[Mn(CN)6] , K2[HgI4] |
| 19 | [Ag(NH3)2]Cl, K2[Zn(CN)4] , K2[Cd(CN)4] |
| 20 | K2[Zn(OH)4], Na[AgCl2] , K2[HgCl4] |
| 21 | K2[SiF6], K2[CdI4] , [Cr(H2O)6]Br 3 |
| 22 | [Co(NH3)5SO4]Br, [Ni(NH3)6](NO3)2, Na[Al(OH)4(H2O)3] |
| 23 | K3[Al(OH)6] , H[AuCL4], (NH4)3[Fe(CN)6] |
| 24 | H2[PtCl6] , [Ag(NH3)2]Cl , [Cu(NH3)4]SO4 |
| 25 | K[Al(OH)4] , K3[Co(NO2)6] , K2[Co(CN)4] |
Таблица 3
| Вариант | Уравнение | ||
| 1 | C2H6(г) + 3,5O2(г) = 2CO2(г) + 2H2O(ж) + 1559,88 кДж | ||
| 2 | C2H2(г) + 2,5O2(г) = 2CO2(г) + H2O(ж) + 1299,63 кДж | ||
| 3 | C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж) + 1410,97 кДж | ||
| 4 | C3H8(г) + 5O2(г) = 3CO2(г) + 4H2O(ж) + 2219,99 кДж | ||
| 5 | C3H6(г) + 4,5O2(г) = 3CO2(г) + 3H2O(ж) + 2017,64 кДж | ||
| 6 | C4H10(г) + 6,5O2(г) = 4CO2(г) + 5H2O(ж) + 3127,94 кДж | ||
| 7 | C4H8(г) + 6O2(г) = 4CO2(г) + 4H2O(ж) + 2718,51 кДж | ||
| 8 | C4H6(г) + 5,5O2(г) = 4CO2(г) + 3H2O(ж) + 2543,46 кДж | ||
| 9 | C5H12(г) + 8O2(г) = 5CO2(г) + 6H2O(ж) + 3536,19 кДж | ||
| 10 | C5H10(г) + 7,5O2(г) = 5CO2(г) + 5H2O(ж) + 3319,51 кДж | ||
| 11 | C3H4(г) + 4O2(г) = 3CO2(г) + 2H2O(ж) + 1944,31 кДж | ||
| 12 | C6H14(г) + 9,5O2(г) = 6CO2(г) + 7H2O(ж) + 3414,22 кДж | ||
| 13 | C6H8(г) + 8O2(г) = 6CO2(г) + 4H2O(ж) + 2331,97 кДж | ||
| Вариант | Вещество | Масса, г | Выделенное тепло, кДж |
| 14 15 16 17 18 19 20 21 22 23 24 25 | Fe Si Li Ca Fe S Na K Cr Zn Сa Mg | 560 2,8 28 160 112 160 46 78 26 13 5 12 | 4100,3 87,2 1190,8 2538,9 539,7 1485,3 416,3 780,0 285,3 40,2 14,0 300,5 |
Таблица 3 а
| Вариант | Уравнения реакций |
| 1 | CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) |
| 2 | CO (г) + H2O (г) = CO2 (г) + H2 (г) |
| 3 | 2H2S (г) + 3O2 = 2H2O (ж) + 2SO2 (г) |
| 4 | 2CH3OH (г) + 3O2 (г) = 4H2O (ж) + 2CO2 (г) |
| 5 | 4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г) |
| 6 | CaCO3 (к) + HCl (ж) = CaCl2 (ж) + CO (г) |
| 7 | 3Fе2О3 (к) + Н2 (г) = 2Fе3O4 (к) + Н2О (г) |
| 8 | Fе2О3 (к) + 3Н2 (г) = 2Fе (к) + 3Н2О (г) |
| 9 | Fе3О4 (к) + 4Н2 (г) = 3Fе (к) + 4Н2О (г) |
| 10 | Fе3О4 (к) + Н2 (г) = 3FеО (к) + Н2О (г) |
| 11 | СО (г) + 2Н2 (г) = СН3ОН (г) |
| 12 | СО(г) + 3Н2 (г) = СН4 (г) + Н2О (г) |
| 13 | Mg0 (к) + H2 (г) = MgCO3 (к) + H2O (ж) |
| 14 | C + 2 N2O = CO2 + 2 N2 |
| 15 | 4NH3 (г) + 3O2 (г) = 2N2 (г) +6H2O (ж) |
| 16 | SO2 (г) + CO2 (г) = SO3 (г) + CO (г) |
| 17 | 4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г) |
| 18 | 2Cl2 (г) + O2 (г) = 2Cl2O (г) |
| 19 | 2ZnS (к) + 3O2 (г) = 2ZnO (к) + 2SO2 (г) |
| 20 | CaO (к) + 3C (граф) = CaC2 (к) + CO (г) |
| 21 | H2S (г) + Cl2 (г) = 2HCl (г) + S (к) |
| 22 | H2S (г) + I2 (г) = 2HI (г) + S (к) |
| 23 | Al2O3 (к) + 3SO3 (г) = Al2(SO4)3 (к) |
| 24 | 2H2S (г) + O2 (г) = 2H2O (г) + 2S (к) |
| 25 | 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) |
Таблица 4
| Номер варианта | Уравнения химических реакций |
| 1 | 2NO (г) + O2  2NO2 (г), 2NO2 (г),  +116,9 кДж +116,9 кДж
|
| 2 | N2 (г) + 3H2 (г)  2NH3 (г), 2NH3 (г),  -9196 кДж -9196 кДж
|
| 3 | Н2 (г) + 1/2 О2 (г)  Н2О (ж), Н2О (ж),  -285,8 кДж -285,8 кДж
|
| 4 | 2Al (т) + 3/2 O2 (г)  Al2O3 (т), Al2O3 (т),  -1675,8 кДж -1675,8 кДж
|
| 5 | 1/2Н2 (г) + 1/2 N2 (г) + 3/2 О2 (г) = НNО3 (ж),  -173,8 кДж -173,8 кДж
|
| 6 | SO2 (г) + 1/2 O2 (г)  SO3 (г), SO3 (г),  98 кДж 98 кДж
|
| 7 | СН4 (г) + 2О2 (г)  СО2 (г) + 2Н2О (г), СО2 (г) + 2Н2О (г),  -802,34 кДж -802,34 кДж
|
| 8 | СН4 (г) + 2Н2О (г)  СО2 (г) + 4Н2 (г), СО2 (г) + 4Н2 (г),  +164,9 кДж +164,9 кДж
|
| 9 | 1/2Н2 (г) + 1/2 Br2 (г)  НBr (г), НBr (г),  -35,97 кДж -35,97 кДж
|
| 10 | С3Н8 (г) + 5О2 (г)  3СО2 (г) + 4Н2О (г), 3СО2 (г) + 4Н2О (г),  -2043,86 кДж -2043,86 кДж
|
| 11 | С6Н12О6 (г) + 6О2 (г)  6СО2 (г) + 6Н2О (ж), 6СО2 (г) + 6Н2О (ж),  -2816 кДж -2816 кДж
|
| 12 | СН3ОН (ж)  СО (г) + 2Н2 (г), СО (г) + 2Н2 (г),  +128,1 кДж +128,1 кДж
|
| 13 | PCl5 (г)  PCl3 (г) + Cl2 (г), PCl3 (г) + Cl2 (г),  +129,6 кДж +129,6 кДж
|
| 14 | Н2 (г) + S (т)  Н2 (г), Н2 (г),  -41,8 кДж -41,8 кДж
|
| 15 | 2HBr (г)  H2 (г) + Br2 (г), H2 (г) + Br2 (г),  -70,2 кДж -70,2 кДж
|
| 16 | Н2 (г) + S (ж)  Н2S (г), Н2S (г),  -20,9 кДж -20,9 кДж
|
| 17 | Fe2O3 (т) + 3H2 (г)  2Fe (т) + 3H2O (г), 2Fe (т) + 3H2O (г),  89,6 кДж 89,6 кДж
|
| 18 | СаО (т) + СО2 (г)  СаСО3 (т), СаСО3 (т),  -178,0 кДж -178,0 кДж
|
| 19 | СО2 (г) + С (т)  2СО (г), 2СО (г),  +160,1 кДж +160,1 кДж
|
| 20 | MgCO3 (т)  MgO (т) + CO2 (г), MgO (т) + CO2 (г),  +117,46 кДж +117,46 кДж
|
| 21 | 2СО (г) + О2 (г)  2СО2 (г), 2СО2 (г),  -568,5 кДж -568,5 кДж
|
| 22 | N2O4 (г)  2NO2 (г), 2NO2 (г),  +58,0 кДж +58,0 кДж
|
| 23 | СО (г) + Н2О (г)  СО2 (г) + Н2 (г), СО2 (г) + Н2 (г),  -41,8 кДж -41,8 кДж
|
| 24 | С (т) + Н2О (г)  СО (г) + Н2 (г), СО (г) + Н2 (г),  +117,04 кДж +117,04 кДж
|
| 25 | N2 (г) + O2 (г)  2NO (г), 2NO (г),  + 180,6 кДж + 180,6 кДж
|
Таблица 5 a
| Номер варианта | Соль | V, л | ω, % | ρ, к/гм3 |
| 1 | AlCl3 | 0,5 | 6 | 1052 |
| 2 | AgNO3 | 1,5 | 8 | 1069 |
| 3 | AgNO3 | 0,8 | 6 | 1050 |
| 4 | Al2(SO4)3 | 0,8 | 6 | 1061 |
| 5 | Al2(SO4)3 | 1,5 | 4 | 1040 |
| 6 | BaCl2 | 3,0 | 4 | 1034 |
| 7 | BaCl2 | 0,3 | 2 | 1015 |
| 8 | CaCl2 | 0,5 | 12 | 1083 |
| 9 | CaCl2 | 0,9 | 4 | 1031 |
| 10 | CuSO4 | 2,5 | 8 | 1084 |
| 11 | CuSO4 | 9,65 | 2 | 1019 |
| 12 | FeCl3 | 0,9 | 12 | 1085 |
| 13 | FeCl3 | 1,7 | 6 | 1049 |
| 14 | FeSO4 | 1,5 | 4 | 1037 |
| 15 | FeSO4 | 3,5 | 8 | 1078 |
| 16 | K2CO3 | 2,0 | 12 | 1090 |
| 17 | K2CO3 | 0,6 | 2 | 1016 |
| 18 | K2Cr2O7 | 2,5 | 8 | 1055 |
| 19 | K2Cr2O7 | 0,4 | 6 | 1040 |
| 20 | K2SO4 | 3,0 | 6 | 1047 |
| 21 | K2SO4 | 1,2 | 12 | 1081 |
| 22 | MgSO4 | 4,0 | 4 | 1039 |
| 23 | MgSO4 | 1,6 | 6 | 1060 |
| 24 | Na2CO3 | 0,5 | 12 | 1102 |
| 25 | Na2CO3 | 3,5 | 2 | 1019 |
Таблица 5 б
| Номер варианта | Основание или кислота | Концентрация, моль/л |
| 1 | КОН | 0,01 |
| 2 | KOH | 0,001 |
| 3 | KOH | 0,1 |
| 4 | KOH | 1·10-4 |
| 5 | KOH | 1·10-5 |
| 6 | NaOH | 0,01 |
| 7 | NaOH | 0,001 |
| 8 | NaOH | 0,1 |
| 9 | NaOH | 1·10-4 |
| 10 | NaOH | 1·10-5 |
| 11 | LiOH | 0,01 |
| 12 | LiOH | 0,001 |
| 13 | HNO3 | 0,01 |
| 14 | HNO3 | 0,001 |
| 15 | HNO3 | 0,1 |
| 16 | HNO3 | 1·10-4 |
| 17 | HNO3 | 1·10-5 |
| 18 | HCl | 0,01 |
| 19 | HCl | 0,001 |
| 20 | HCl | 1·10-4 |
| 21 | HCl | 1·10-5 |
| 22 | HCl | 0,1 |
| 23 | HI | 0,01 |
| 24 | HI | 1·10-3 |
| 25 | HI | 1·10-4 |
Таблица 5 в
| Номер варианта | Формулы солей | |||
| 1 | NaCl | Na2CO3 | AlCl3 | Al2(CO3)3 |
| 2 | NA2SO4 | K2CO3 | Al2(SO4)3 | AgBr |
| 3 | NaNO3 | Li2CO3 | Al(No3)3 | Ag2CO3 |
| 4 | KCl | Rb2CO3 | ZnCl2 | AgCl |
| 5 | K2SO4 | Cs2CO3 | ZnBr2 | AgI |
| 6 | KNO3 | Na2SiO3 | ZnI2 | Ag3PO4 |
| 7 | Li2SO4 | K2SiO3 | Zn(NO3)2 | Ag2S |
| 8 | LiCl | Li2SiO3 | ZnSO4 | Ag2SO4 |
| 9 | LiNO3 | K2S | CuCl2 | BaCO3 |
| 10 | Rb2SO4 | Na2S | CuBr2 | BaCrO4 |
| 11 | RbCl | K2SO3 | Cu(NO3)2 | BaSO4 |
| 12 | RbNO3 | Na2SO3 | CuSO4 | CaCo3 |
| 13 | CsCl | K3PO4 | MnCl2 | Ca3(PO4)2 |
| 14 | Cs2SO4 | Na3PO4 | MnBr2 | CaSO4 |
| 15 | CsNO3 | Li2S | Mn(NO3)2 | CdCO3 |
| 16 | FrCl3 | K2S | MnSO4 | CuCO3 |
| 17 | Fr2SO4 | Na2SiO3 | FeCl2 | CuS |
| 18 | FrNO3 | Li2CO3 | FeBr2 | FeS |
| 19 | NaF | Li2SiO3 | FeI2 | MgS |
| 20 | KF | Li2SO3 | Fe(NO3)2 | MnCO3 |
| 21 | LiF | Cs2CO3 | FeSO4 | MnS |
| 22 | CsF | K2S | SnCl2 | PbCO3 |
| 23 | LiI | K2HPO4 | CuF2 | PbI2 |
| 24 | NaI | NaHCO3 | FeF2 | MnI2 |
| 25 | CsI | NaHSiO3 | AlF3 | CaSO3 |
Таблица 5 г
| Вариант | Соль I | Соль II | С, моль/л | Труднораствори- мое соединение | ПР труднораст- воримого сое- динения при 250С |
| 1 | SrCl2 | K2SO4 | 0,002 | SrSO4 | 2,8·10-7 |
| 2 | AgNO3 | NaBr | 0,001 | AgBr | 6,3·10-13 |
| 3 | AgNO3 | K2CO3 | 0,001 | Ag2CO3 | 6,15·10-12 |
| 4 | AgNO3 | KCl | 0,002 | AgCl | 1,56·10-10 |
| 5 | AgNO3 | KI | 0,001 | AgI | 1,5·10-16 |
| 6 | AgNO3 | Na3PO4 | 0,001 | Ag3PO4 | 1,8·10-18 |
| 7 | AgNO3 | Na2S | 0,0001 | Ag2S | 5,7·10-51 |
| 8 | AgNO3 | K2SO4 | 0,002 | Ag2SO4 | 7,7·10-5 |
| 9 | BaCl2 | Na2SO3 | 0,001 | BaCO3 | 7,0·10-9 |
| 10 | Ba(NO3)2 | Na2CrO4 | 0,002 | BaCrO4 | 2,3·10-10 |
| 11 | BaCl2 | K2SO4 | 0,002 | BaSO4 | 1,08·10-10 |
| 12 | CaCl2 | K2CO3 | 0,001 | CaCO3 | 4,8·10-9 |
| 13 | Ca(NO3)2 | Na3PO4 | 0,002 | Ca3(PO4)2 | 1,0·10-25 |
| 14 | CaCl2 | Na2SO4 | 0,001 | CaSO4 | 6,1·10-5 |
| 15 | Cd(NO3)2 | Na2CO3 | 0,001 | CdCO3 | 2,5·10-14 |
| 16 | CuCl2 | Na2CO3 | 0,002 | CuCO3 | 2,36·10-10 |
| 17 | Pb(NO3)2 | NaCl | 0,002 | PbCl2 | 1,7·10-5 |
| 18 | Pb(NO3)2 | K2CO3 | 0,001 | PbCO3 | 1,5·10-13 |
| 19 | MgCl2 | K2S | 0,001 | MgS | 2,0·10-15 |
| 20 | Ni(NO3)2 | K2S | 0,001 | NiS | 3,2·10-19 |
| 21 | Pb(NO3)2 | NaBr | 0,001 | PbBr2 | 9,1·10-6 |
| 22 | SrCl2 | Na2CO3 | 0,002 | SrCO3 | 9,42·10-10 |
| 23 | ZnCl2 | K2CO3 | 0,001 | ZnCO3 | 6,0·10-11 |
| 24 | Zn(NO3)2 | K2S | 0,001 | ZnS | 1,6·10-24 |
| 25 | Sr(NO3)2 | NaF | 0,001 | SrF2 | 2,5·10-9 |
Таблица 1.11
| Номер варианта | Схемы окислительно-восстановительных реакций |
| 1 | MnSO4 + NaHSO4 + H2O + Cl2  MnO2 + NaCl + H2SO4 MnO2 + NaCl + H2SO4
|
| 2 | HMnO4 + Pb(NO3)2 + H2O  PbO2 + Mn(NO3)2 + HNO3 PbO2 + Mn(NO3)2 + HNO3
|
| 3 | MnSO4+Br2+Na2SO4+K2SO4 + H2O  KMnO4 + NaBr + H2SO4 KMnO4 + NaBr + H2SO4
|
| 4 | K2SO4 + I2 + NO2 + H2O  KI + HNO3 + H2SO4 KI + HNO3 + H2SO4
|
| 5 | K2SO4 + Cr2(SO4)3 + H2O  K2Cr2O7 + H2SO4 + SO2 K2Cr2O7 + H2SO4 + SO2
|
| 6 | Al +K2Cr2O7 + H2SO4  Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
|
| 7 | KClO3 + FeSO4 + H2SO4  KCl + Fe2(SO4)3 + H2O KCl + Fe2(SO4)3 + H2O
|
| 8 | K2Cr2O7 + KI + H2SO4  Cr2(SO4)3 + I2 + K2SO4 + H2O Cr2(SO4)3 + I2 + K2SO4 + H2O
|
| 9 | KBrO + MnCl2 + KOH  KBr + MnO2 + KCl + H2O KBr + MnO2 + KCl + H2O
|
| 10 | O2 + Pb(CH3COO)2 + H2O  H2O2 + PbO2 + CH3COOH H2O2 + PbO2 + CH3COOH
|
| 11 | Na2SO4 + Ag + NaNO3 + H2O  Na2SO3 + AgNO3 + NaOH Na2SO3 + AgNO3 + NaOH
|
| 12 | KMnO4 + HCl  KCl + Cl2 + MnCl2 + H2O KCl + Cl2 + MnCl2 + H2O
|
| 13 | KMnO4 + H2O2 + KOH  K2MnO4 + O2 + H2O K2MnO4 + O2 + H2O
|
| 14 | K2Cr2O7 + H2S + H2SO4  Cr2(SO4)3 + S + K2SO4 + H2O Cr2(SO4)3 + S + K2SO4 + H2O
|
| 15 | CO2 + MnSO4 + H2O  H2C2O4 + MnO2 + H2SO4 H2C2O4 + MnO2 + H2SO4
|
| 16 | FeCl2 + KMnO4 + HCl(р)  FeCl3 + MnCl2 + KCl + H2O FeCl3 + MnCl2 + KCl + H2O
|
| 17 | CrCl3 + Br2 + KOH  K2CrO4 + KBr + HCl + H2O K2CrO4 + KBr + HCl + H2O
|
| 18 | Na2C2O4+KMnO4+H2SO4  MnSO4+K2SO4+Na2SO3+H2O+CO2 MnSO4+K2SO4+Na2SO3+H2O+CO2
|
| 19 | K2Cr2O7 + H2SO4 + FeSO4  K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O
|
| 20 | KClO3 + Na2C2O4 + HCl  KCl + NaCl + H2O + CO2 KCl + NaCl + H2O + CO2 
|
| 21 | Ti2(SO4)3+ KMnO4+ H2SO4  Ti(SO4)2 + MnSO4 + K2SO4 + H2O Ti(SO4)2 + MnSO4 + K2SO4 + H2O
|
| 22 | MnSO4 + K2SO4 + O2 + H2O  H2O2 + KMnO4 + H2SO4 H2O2 + KMnO4 + H2SO4
|
| 23 | FeSO4 + HNO3 + H2SO4  Fe2(SO4)3 +NO+ H2O Fe2(SO4)3 +NO+ H2O
|
| 24 | NaNO2 + NaI + H2SO4  NO + I2 + Na2SO4 + H2O NO + I2 + Na2SO4 + H2O
|
| 25 | KI + KNO2 + H2SO4  I2 + K2SO4 + NO + H2O I2 + K2SO4 + NO + H2O
|
Таблица 6.2
| Номер варианта | Металлы |
| 1 | Cu,Ag |
| 2 | Cu,Au |
| 3 | Cu,Al |
| 4 | Cu,Zn |
| 5 | Cu,Ni |
| 6 | Mg,Al |
| 7 | Mg,Fe |
| 8 | Mg,Zn |
| 9 | Mg,Co |
| 10 | Mg,Au |
| 11 | Ni,Fe |
| 12 | Ni,Co |
| 13 | Ni,Al |
| 14 | Ni,Sn |
| 15 | Ni,Cd |
| 16 | Fe,Co |
| 17 | Fe,Al |
| 18 | Fe,Pb |
| 19 | Fe,Sn |
| 20 | Fe,Au |
| 21 | Co,Al |
| 22 | Co,Au |
| 23 | Al,Zn |
| 24 | Sn,Mg |
| 25 | Pb,Cu |
Таблица 6.3
| Номер варианта | Формула соли | I, A | T, мин | Bi, % |
| 1 | CuCl2 | 3 | 60 | 80 |
| 2 | ZnSO4 | 2,5 | 60 | 60 |
| 3 | SnCl2 | 2,8 | 60 | 70 |
| 4 | Cr2(SO4)3 | 1,5 | 45 | 25 |
| 5 | MnCl2 | 3,5 | 30 | 35 |
| 6 | FeSO4 | 3,2 | 45 | 40 |
| 7 | ZnCl2 | 4,1 | 30 | 55 |
| 8 | CrCl3 | 3,6 | 30 | 20 |
| 9 | MnSO4 | 1,9 | 45 | 25 |
| 10 | NiSO4 | 4,2 | 30 | 65 |
| 11 | NiCl2 | 3,3 | 45 | 70 |
| 12 | CoCl2 | 1,4 | 45 | 60 |
| 13 | CoSO4 | 1,7 | 45 | 60 |
| 14 | Zn(NO3)2 | 1,9 | 45 | 65 |
| 15 | Co(NO3)2 | 1,8 | 60 | 60 |
| 16 | Fe(NO3)2 | 2,4 | 60 | 40 |
| 17 | CuBr2 | 2,7 | 60 | 90 |
| 18 | ZnI2 | 2,2 | 45 | 55 |
| 19 | CrBr3 | 3,4 | 30 | 55 |
| 20 | MnI2 | 4,0 | 60 | 60 |
| 21 | AgNO3 | 5,1 | 45 | 95 |
| 22 | FeI2 | 6,2 | 60 | 45 |
| 23 | MnCl2 | 3,6 | 60 | 60 |
| 24 | Cr(SO4)3 | 4,1 | 40 | 30 |
| 25 | Cu(NO3)2 | 2,7 | 45 | 70 |
Таблица 6.4
| Номер варианта | Формулы оксидов металлов, образую- щихся при газовой коррозии |
| 1 | Bi2O3 (к) |
| 2 | CdO (к) |
| 3 | Cr2O3 (к) |
| 4 | CuO (к) |
| 5 | Ga2O3 (к) |
| 6 | MnO2 (к) |
| 7 | MoO2 (к) |
| 8 | CoO (к) |
| 9 | CrO3 (к) |
| 10 | Cu2O (к) |
| 11 | NbO (к) |
| 12 | NiO (к) |
| 13 | PbO (к) |
| 14 | SnO (к) |
| 15 | TiO2 (к) |
| 16 | WO3 (к) |
| 17 | ZnO (к) |
| 18 | ZrO2 (к) |
| 19 | FeO (к) |
| 20 | Fe3O4 (к) |
| 21 | GeO2 (к) |
| 22 | MnO (к) |
| 23 | Mn3O4 (к) |
| 24 | Co3O4 (к) |
| 25 | Cu2O (к) |
Таблица 6.5
| Номер варианта | Металлы | рН | Тип деполяризации |
| 1 | Fe,Ni | <7 | кислородная |
| 2 | Fe,Mn | <7 | водородная |
| 3 | Fe,Ag | <7 | водородная |
| 4 | Ni,Mn | <7 | водородная |
| 5 | Ni,Co | <7 | водородная |
| 6 | Mn,Cu | <7 | водородная |
| 7 | Ag,Cr | <7 | водородная |
| 8 | Ag,Co | <7 | водородная |
| 9 | Ag,Cd | <7 | водородная |
| 10 | Fe,Zn | <7 | водородная |
| 11 | Zn,Sn | 7 | кислородная |
| 12 | Pb,Cr | 7 | кислородная |
| 13 | Co,Cu | 7 | кислородная |
| 14 | Cr,Co | 7 | кислородная |
| 15 | Cr,Cd | >7 | кислородная |
| 16 | Cr,Cu | >7 | кислородная |
| 17 | Cr,Sn | 7 | кислородная |
| 18 | Cr,Bi | >7 | кислородная |
| 19 | Cr,Hf | 7 | кислородная |
| 20 | Fe,Sn | <7 | кислородная |
| 21 | Fe,Pb | <7 | кислородная |
| 22 | Fe,Cr | <7 | кислородная |
| 23 | Ni,Ag | 7 | кислородная |
| 24 | Mn,Zn | <7 | водородная |
| 25 | Zn,Sb | <7 | водородная |
ПРИЛОЖЕНИЕ 2
Таблица 1
Термодинамические величины простых веществ
и соединений в стандартных условиях
| Вещество | 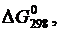 кДж/моль
кДж/моль
|  кДж/моль
кДж/моль
|  Дж/моль∙K
Дж/моль∙K
|  кДж/моль
кДж/моль
|
| 1 | 2 | 3 | 4 | 5 |
| Ag (k) | 0 | 0 | 42,69 | -30,56 |
| Ag2O (k) | -10,82 | -30,56 | 121,81 | - |
| AgCl (k) | -109,7 | -127,07 | 96,07 | - |
| AgBr (k) | -94,9 | -99,16 | 107,1 | - |
| AgI (k) | -66,3 | -64,2 | 144,2 | - |
| Al (k) | 0 | 0 | 28,31 | -1674 |
| Al2O3 (k) | -1580 | -1674 | 50,94 | - |
| KCl (k) | -408,32 | - | - | - |
| KClO3 (k) | -289,91 | - | - | - |
| MnO2 (k) | -466,1 | -519,4 | 53,14 | - |
| Mn(OH)2 (k) | -610,4 | -693,7 | 88,28 | - |
| MnCl2 (k) | -441,4 | -468,6 | 117,15 | - |
| N2 (г) | 0 | 0 | 191,5 | - |
| NH3 (г) | -16,7 | -46,9 | 192,5 | - |
| N2H4 (ж) | 149,2 | 50,4 | 121,3 | - |
| NH4OH (р) | -254,2 | -361,2 | 165,4 | - |
| NH4Cl (k) | -203,9 | -315,4 | 94,56 | - |
| (NH4)2SO4 (k) | -900,3 | -1179,3 | 220,3 | - |
| NO (г) | 86,7 | 90,37 | 210,6 | - |
| NO2 (г) | 51,8 | 33,50 | 240,45 | - |
| N2O4 (г) | 98,28 | 9,66 | 304,3 | - |
| NaF (k) | -543,5 | -570,3 | 51,3 | - |
| NaCl (k) | -384,9 | -410,9 | 72,8 | - |
| NaBr (k) | -347,7 | -359,8 | 83,7 | - |
| NaI (k) | -284,5 | -287,9 | 91,2 | - |
| NaOH (k) | -381,1 | -427,8 | 64,18 | - |
| Na2SO4 (k) | -1267 | -1384 | 149,4 | - |
| Na2CO3 (k) | -1048 | -1129 | 136,0 | - |
| Ni (k) | 0 | 0 | 29,86 | - |
| NiO (k) | -216,5 | -239,5 | 38,0 | - |
| Ni(OH)2 (k) | -453,1 | -538,0 | 79,5 | - |
| O (г) | 231,7 | 249,18 | 169,95 | - |
| Продолжение табл.1
| ||||
| 1 | 2 | 3 | 4 | 5 |
| O2 (г) | 0 | 0 | 205,0 | - |
| O3 (г) | 163,4 | 142,3 | 238,8 | - |
| PH3 (г) | 12,5 | - | - | - |
| Pb (k) | 0 | 0 | 64,9 | - |
| PbBr2 (k) | -260,4 | -277,0 | 161,4 | - |
| PbCl2 (k) | -314,0 | -359,1 | 136,4 | - |
| PbI2 (k) | -173,8 | -175,1 | 176,4 | - |
| PbS (k) | -92,7 | -94,8 | 91,2 | - |
| PbSO4 (k) | -811,2 | 918,1 | 147,28 | - |
| PbO (k) | -188,5 | -217,8 | 69,45 | - |
| PbO2 (k) | -219,0 | -276,6 | 76,44 | - |
| SO2 (г) | -300,4 | -296,9 | 248,1 | - |
| SO3 (г) | -370,4 | -395,2 | 256,23 | - |
| Al(OH)3 (k) | -1139,7 | -1605,5 | 85,35 | - |
| Al2(SO4)3 (k) | -3434,0 | 239,2 | - | |
| BaO (k) | -528,4 | -557,9 | 70,29 | - |
| Ba(OH)2 (k) | -946,1 | 103,8 | - | |
| BaCO3 (k) | -1139 | -1202 | 112,1 | - |
| BaSO4 (k) | -352 | -1465 | 131,8 | - |
| Br2 (г) | 3,14 | 30,92 | 245,35 | - |
| Br2 (ж) | 0 | 0 | 152,3 | - |
| C (графит) | 0 | 0 | 5,74 | -396,3 |
| C (алмаз) | 2,866 | 1,897 | 2,38 | -394,1 |
| CO (г) | -138,4 | -110,5 | 197,4 | -364,6 |
| CO2 (г) | -394,4 | -396,3 | 213,6 | - |
| CH4 (г) | -50,5 | -74,85 | 186,19 | -890,31 |
| CCl4 (г) | -63,95 | -106,7 | 309,7 | -156,1 |
| C2H2 (г) | 209,2 | 226,75 | 200,8 | -1299,63 |
| C2H4 (г) | 68,1 | 52,28 | 219,4 | -1410,97 |
| C2H6 (г) | -32,9 | -84,67 | 229,5 | -1559,88 |
| C3H8 (г) | -107,15 | -104,0 | 269,9 | -2220,0 |
| C3H6 (г) | 62,7 | 20,42 | 226,9 | -1909,6 |
| C4H10 (г) | -17,15 | -124,7 | 310,0 | 2878,4 |
| C4H8 (г) | 71,5 | 1,17 | 307,4 | -2542,5 |
| C6H6 (г) | 129,7 | 82,93 | 269,2 | -3301,7 |
| C6H6 (ж) | 124,5 | 49,0 | 173,2 | -3267,7 |
| CH3OH (ж) | -166,1 | -238,6 | 126,8 | -726,6 |
| C2H5OH (ж) | -174,8 | -277,6 | 160,4 | -1366,9 |
| CS2 (г) | 65,06 | 11,53 | 237,8 | -1075 |
| Ca (k) | 0 | 0 | 41,62 | -635,1 |
| Продолжение табл. 1
| ||||
| 1 | 2 | 3 | 4 | 5 |
| CaO (k) | -604,2 | -635,1 | 39,70 | - |
| Ca(OH)2 (k) | -896,7 | -986,2 | 76,98 | - |
| CaCO3 (k) | -1128,8 | -1206 | 92,90 | - |
| CaCl2 (k) | -750,2 | -785,8 | 113,8 | - |
| CaSO4 (k) | -1318,3 | -1424 | 106,7 | - |
| Cd (k) | 0 | 0 | 51,76 | -60,9 |
| CdO (k) | -225,0 | -256,1 | 54,80 | - |
| Cd(OH)2 (k) | -460,5 | -553,2 | 95,40 | - |
| CdCl2 (k) | -342,6 | -389,0 | 115,30 | - |
| Cl2 (г) | 0 | 0 | 223,0 | - |
| Cr (k) | 0 | 0 | 23,76 | -1141 |
| Cr2O3 (k) | -1058 | -1141 | 81,1 | - |
| CrO3 (k) | -505,8 | -594,5 | 72 | - |
| Cr(OH)3 (k) | -902,5 | -1033,9 | 80,30 | - |
| Cu (k) | 0 | 0 | 33,30 | -165,0 |
| CuC (k) | -127,0 | -165,0 | 42,64 | - |
| Cu(OH)2 (k) | -359,4 | -448,5 | 79,50 | - |
| CuSO4 (k) | -661,9 | -771,1 | 113,3 | - |
| F2 (г) | 0 | 0 | 202,9 | - |
| Fe (k) | 0 | 0 | 27,15 | - |
| FeO (k) | -244,3 | -263,7 | 58,79 | - |
| Fe2O3 (k) | -741,5 | -821,32 | 89,92 | - |
| Fe(OH)2 (k) | -483,5 | -568,0 | 79,5 | - |
| Fe(OH)3 (k) | -699,6 | -824,2 | 96,2 | - |
| H2 (г) | 0 | 0 | 130,6 | -241,84 |
| H2O (k) | -291,85 | 44,1 | - | |
| H2O (ж) | -237,2 | -285,84 | 70,1 | - |
| H2O (г) | -228,4 | -241,84 | 188,8 | - |
| H2S (г) | -33,3 | -20,15 | 205,64 | - |
| HF (г) | -296,6 | -270,7 | 173,5 | - |
| HCl (г) | -95,27 | -92,30 | 186,7 | - |
| HBr (г) | -53,5 | -35,98 | 198,5 | - |
| HI (г) | 1,3 | 25,4 | 206,3 | - |
| HNO3 (k) | -110,4 | -173,2 | 156,16 | - |
| H2SO4 (ж) | -1119 | -1283,6 | 176,15 | - |
Окончание табл.1
| 1 | 2 | 3 | 4 | 5 |
| I2 (г) | -690,3 | -805,0 | 156,9 | - |
| I2 (k) | 19,37 | 62,24 | 260,6 | - |
| KOH (k) | 0 | 0 | 116,7 | - |
| LiOH (k) | -425,9 | 59,41 | - | |
| Mg (k) | -443,9 | -487,8 | 42,70 | - |
| MgO (k) | 0 | 0 | 32,55 | -601,2 |
| Mg(OH)2 (k) | -569,4 | -601,2 | 26,94 | - |
| MgCO3 (k) | -833,8 | -824,7 | 63,14 | - |
| MgSO4 (k) | -1029 | -1096 | 65,69 | - |
| SiO2 (l-кварц) | -847,2 | -853,3 | 42,09 | - |
| Zn (k) | 0 | 0 | 41,59 | - |
| ZnO (k) | -318,2 | -349,0 | 43,5 | - |
| Zn(OH)2 (k) | -554,4 | -642,2 | 84,9 | - |
| ZnS (k) | -239,8 | -201 | 57,7 | - |
| ZnSO4 (k) | -870,7 | -978,2 | 124,6 | - |
Таблица 2
Термодинамические константы некоторых ионов
в водных растворах
| Ион | 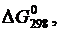 кДж/моль
кДж/моль
|  кДж/моль
кДж/моль
|  Дж/моль∙K
Дж/моль∙K
|
| 1 | 2 | 3 | 4 |
| Ag+ | 77,11 | 105,90 | 73,93 |
| Al3+ | -481,2 | -524,7 | -313,4 |
| Ba2+ | -560,7 | -538,36 | 13,0 |
| Br- | -102,82 | -120,92 | 80,71 |
| CH3COO- | -375,39 | -448,87 | - |
| CN- | 165,7 | 151,0 | 92,0 |
CO 
| -528,10 | -676,26 | -53,1 |
| Ca2+ | -553,04 | 542,96 | -55,2 |
| Cd2+ | -77,74 | -72,38 | -61,1 |
| Cl- | -131,17 | -167,46 | 55,10 |
ClO 
| -2,59 | -98,38 | -163,2 |
| Co2+ | -51,5 | 67,4 | -111,7 |
| CrO2- | -706,3 | -863,2 | 38,5 |
| Продолжение табл. 2
| |||
| 1 | 2 | 3 | 4 |
Cr2O 
| -1305,4 | -1491,7 | - |
| Cs+ | -282,04 | -247,7 | 133,1 |
| Cu+ | 50,2 | 71,5 | 39,3 |
| Cu2+ | 64,98 | 64,39 | -98,7 |
| F- | -276,48 | -329,11 | -9,6 |
| Fe2+ | -84,94 | -87,9 | -113,4 |
| Fe3+ | -10,54 | -47,7 | -293,3 |
| H+ | 0 | 0 | 0 |
| HCOO- | -334,7 | -410,0 | 91,6 |
HCO 
| -587,06 | -691,11 | 95,0 |
| Hg2+ | 164,77 | 174,01 | -22,6 |
| HS- | 12,59 | 17,66 | 61,1 |
HSO 
| -527,3 | -627,98 | 132,38 |
HSO 
| -752,87 | -885,75 | 126,86 |
| I- | -51,67 | -55,94 | 109,37 |
| IO- | -135,6 | -230,1 | 115,9 |
| K+ | -282,28 | -251,21 | 102,5 |
| Li+ | -293,80 | -278,46 | 14,2 |
| Mg2+ | -456,01 | -461,96 | -118,0 |
| Mn2+ | -223,4 | -218,8 | -79,9 |
MnO 
| -425,1 | -518,4 | 190,0 |
NH 
| -79,5 | -132,8 | 112,84 |
NO 
| -35,35 | -106,3 | 125,1 |
NO 
| -110,80 | -206,57 | 146,4 |
| Na+ | -261,87 | -239,66 | 60,2 |
| Ni2+ | -64/4 | -64,0 | -123,0 |
| OH- | -157,3 | -229,94 | -10,54 |
PO 
| -1025,5 | -1284,1 | -218 |
| Pb2+ | -24,3 | 1,63 | 21,3 |
| Rb+ | -282,21 | -246,4 | 124,3 |
| S2- | 83,7 | 41,8 | -26,8 |
SO 
| -742,99 | -907,51 | 17,2 |
| Sr2+ | -557,3 | -545,51 | -26,4 |
| Zn2+ | -147,21 | -152,42 | -106,48 |
Таблица 3
Стандартные электродные потенциалы
| Электрохимическая система | 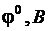
|
| 1 | 2 |
AgCl +  = Ag + Cl = Ag + Cl 
| 0,2222 |
Cu2+ +  = Cu+ = Cu+
| 0,153 |
Hg2Cl2 + 2  = 2Hg + 2Cl = 2Hg + 2Cl 
| 0,2696 |
Hg2O + 2  + H2O = 2Hg + 2OH + H2O = 2Hg + 2OH 
| 0,123 |
2ClO  + 12H+ + 10 + 12H+ + 10  = Cl2 (г) + 6H2O = Cl2 (г) + 6H2O
| 1,47 |
H2 = 2H+ + 2 
| 0 |
2H2O + 2  = 2OH = 2OH  + H2, pH > 7 + H2, pH > 7
| -0,828 |
2H2O + 2  = 2OH = 2OH  + H2, pH = 7 + H2, pH = 7
| -0,414 |
O2 + 4H+ + 4  = 2H2O = 2H2O
| 1,229 |
O2 + 2H2O + 4  = 4OH = 4OH 
| 0,401 |
N2H4 + 4OH  = N2 + 4H2O + 4 = N2 + 4H2O + 4 
| -1,16 |
CH3OH + 8OH  = CO = CO  + 6H2O + 6 + 6H2O + 6 
| -0,91 |
CH3OH + H2O = CO2 + 6H+ + 6 
| 0,017 |
Li = Li+ + 
| -3,045 |
2SOCl2 + 4  = SO2 + S + 2Cl = SO2 + S + 2Cl 
| 0 |
Mg0 = Mg2+ + 2 
| -2,363 |
MnO2 + H+ +  = MnOOH = MnOOH
| 0,5 |
C6H4(NO2)2 + 6H2O + 8  = C6H4(NHOH)2 + 8OH = C6H4(NHOH)2 + 8OH 
| -0,163 |
NiOOH + H2O +  = Ni(OH)2 + OH = Ni(OH)2 + OH 
| 0,49 |
H2O2 = O2 + 2H+ + 2 
| 0,6824 |
MnO  + 8H+ + 5 + 8H+ + 5  = Mn2+ + 4H2O = Mn2+ + 4H2O 
| 1,52 |
HNO2 (aq) + H+ +  = NO (г) + H2O = NO (г) + H2O
| 1,0 |
I2 + 2  = 2I = 2I 
| 0,5355 |
MnO2 + 4H+ + 2  = Mn2+ + 2H2O = Mn2+ + 2H2O
| 1,23 |
S2- = S0 + 2 
| -0,48 |
Cr2O  + 14H+ + 6 + 14H+ + 6  = 2Cr3+ + 7H2O = 2Cr3+ + 7H2O
| 1,33 |
Fe2+ = Fe3+ + 
| 0,771 |
ClO   + 6H+ + 6 + 6H+ + 6  = Cl = Cl  + 3H2O + 3H2O
| 1,45 |
Продолжение табл.3
| 1 | 2 |
SO2 + 2H2O = SO  + 4H+ + 2 + 4H+ + 2 
| 0,138 |
NO  + 2H+ + + 2H+ +  = NO2 (г) + H2O = NO2 (г) + H2O
| 0,80 |
NO  + 4H+ + 3 + 4H+ + 3  = NO + 2H2O = NO + 2H2O
| 0,957 |
2Br  = Br2 + 2 = Br2 + 2 
| 1,07 |
PbO2 + 4H+ + 2  = Pb2+ + 2H2O = Pb2+ + 2H2O
| 1,68 |
C2O  = 2CO2 + 2 = 2CO2 + 2 
| -0,50 |
MnO  + 1 + 1  = MnO = MnO 
| 0,564 |
2Cl  = Cl2 + 2 = Cl2 + 2 
| 1,359 |
NO  + 3H+ + 2 + 3H+ + 2  = HNO2 + H2O = HNO2 + H2O
| 0,960 |
PbO2 + 4H+ + SO  + 2 + 2  = PbSO4 + 2H2O = PbSO4 + 2H2O
| 1,682 |
Zn = Zn2+ + 2 
| -0,763 |
Al = Al3+ + 3 
| -1,662 |
CrO  + 4H2O + 3 + 4H2O + 3  = Cr(OH)3 + 5OH = Cr(OH)3 + 5OH 
| -0,13 |
2IO  + 12H+ + 10 + 12H+ + 10  = I2 + 6H2O = I2 + 6H2O
| 1,195 |
SO  + 4H+ + 2 + 4H+ + 2  = H2SO3 (aq) + H2O = H2SO3 (aq) + H2O
| 0,172 |
Ag = Ag+ + 
| 0,799 |
SO  + 2OH + 2OH  = SO = SO  + H2O + 2 + H2O + 2 
| -0,93 |
Ti4+ +  = Ti3+ = Ti3+
| -0,04 |
BrO  + H2O + 2 + H2O + 2  = Br = Br  + 2OH + 2OH 
| 0,761 |
MnO2 + 2H2O + 2  = Mn(OH)2 + 2OH = Mn(OH)2 + 2OH 
| -0,05 |
Pb2+ + 2  = Pb0 = Pb0
| -0,126 |
Cr3+ + 3  = Cr0 = Cr0
| -0,744 |
Mn2+ + 2  = Mn0 = Mn0
| -1,180 |
Co2+ + 2  = Co0 = Co0
| -0,277 |
Fe2+ + 2  = Fe0 = Fe0
| -0,44 |
Cd2+ + 2  = Cd0 = Cd0
| -0,4029 |
Cu2+ + 2  = Cu0 = Cu0
| 0,337 |
Sn2+ + 2  = Sn0 (белый) = Sn0 (белый)
| -0,136 |
Au3+ + 3  = Au0 = Au0
| 1,498 |
|
| |
Окончание табл.3
Sb3+ + 3  = Sb0 = Sb0
| 0,24 |
Re3+ + 3  = Re0 = Re0
| 0,300 |
Pd2+ + 2  = Pd0 = Pd0
| 0,987 |
Sn4+ + 4  = Sn2+ = Sn2+
| 0,009 |
Nd3+ + 3  = Nd0 = Nd0
| -2,431 |
Cr2+ + 2  = Cr0 = Cr0
| -0,913 |
Ni2+ + 2  = Ni0 = Ni0
| -0,25 |
In3+ + 3  = In0 = In0
| -0,343 |
Fe3+ + 3  = Fe0 = Fe0
| -0,036 |
2H+ + 2  = H2 = H2
| 0 |
Таблица 4
Перенапряжения катодного восстановления некоторых ионов
(при i = 0,01 A/см2)
| Ион | 
| Ион | 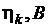
| Ион | 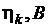
| Ион | 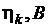
|
| Zn2+ | 0,03 | Re3+ | 0,65 | H+ (на Ag) | 0,47 | H+ (на Re) | 0,6 |
| Ag+ | 0,18 | Pd2+ | 0,48 | (на Au) | 0,24 | (на Pd) | 0,3 |
| Pb2+ | 0,4 | Sn4+ | 0,35 | (на Zn) | 0,72 | (на Mn) | 0,45 |
| Cr3+ | 0,41 | Cr2+ | 0,22 | (на Cd) | 0,98 | (на Co) | 0,50 |
| Mn2+ | 0,5 | Ni2+ | 0,11 | (на Sn) | 0,86 | (на Au | 0,3 |
| Co2+ | 0,5 | In3+ | 0,18 | (на Pb) | 0,52 | (на Ne) | 0,45 |
| Fe2+ | 0,11 | Fe3+ | 0,3 | (на Cr) | 0,5 | (на In) | 0,26 |
| Cd2+ | 0,03 | Sn2+ | 0,01 | (на Fe) | 0,5 | (на Sb) | 0,5 |
| Cu2+ | 0,06 | Sb3+ | 0,6 | (на Ni) | 0,63 | ||
| Au3+ | 0,35 | (на Cu) | 0,48 |
Таблица 5
Упругости диссоциации оксидов
| Оксид | Т, К |  ,равновесн., Па ,равновесн., Па
| Оксид | Т, К |  ,равновесн., Па ,равновесн., Па
|
| Fe2O3 | 500 | 1,013·10-45 | FeO | 750 | 1·10-42 |
| Ag2O | 600 | 3,6·107 | CoO | 750 | 1·10-32 |
| Cu2O | 500 | 5,6·10-26 | Sb2O3 | 500 | 1·10-36 |
| PbO | 1600 | 4,4·10-2 | PdO | 500 | 1·10-10 |
| NiO | 2000 | 9,3·10-1 | MoO3 | 500 | 1·10-39 |
| ZnO | 1800 | 6,8·10-9 | CdO | 1000 | 1·10-19 |
| Al2O3 | 1600 | 1,5·10-22 | GeO2 | 1000 | 1·10-18 |
| V2O3 | 500 | 1· 10-70 | WO3 | 750 | 1·10-37 |
| TiO2 | 1000 | 1·10-40 | SnO2 | 1000 | 1·10-21 |
| ZrO2 | 1000 | 1·10-42 | In2O3 | 450 | 1·10-55 |
| BeO | 1000 | 1·10-44 | Mn3O4 | 1000 | 1·10-37 |
| MgO | 1000 | 1·10-50 | Nb2O5 | 750 | 1·10-43 |
| Sc2O3 | 500 | 1·10-110 | Cr2O3 | 750 | 1·10-44 |
| Tl2O3 | 400 | 1·10-20 | Ta2O5 | 500 | 1·10-70 |
| Bi2O3 | 500 | 1·10-35 | RuO2 | 450 | 1·10-21 |
| CuO | 750 | 1·10-20 |
Таблица 6
 образования оксидов металлов
образования оксидов металлов
| Формула |  , кДж/моль , кДж/моль
| Формула |  , кДж/моль , кДж/моль
|
| Al2O3 | -1576,4 | CoO | -502,42 |
| Fe2O3 | -740,99 | Sb2O3 | -293,08 |
| Ag2O | -10,82 | PdO | -125,61 |
| Cu2O | -146,36 | MoO3 | -502,42 |
| PbO | -188,49 | CdO | -225,06 |
| NiO | -216,4 | GeO2 | -531,4 |
| ZnO | -318,19 | WO3 | -535,91 |
| V2O3 | -795,49 | SnO2 | -519,7 |
| TiO2 | -852,7 | In2O3 | -838,9 |
| ZrO2 | -1022,6 | Nb2O5 | -731,64 |
| BeO | -581,61 | Cr2O3 | -1046,84 |
| MgO | -569,57 | Ta2O5 | -795,49 |
| Sc2O3 | -1004,83 | RuO2 | -205,15 |
| Tl2O3 | -217,71 | CuO | -127,19 |
| Bi2O3 | -1184,0 | FeO | -244,35 |
Таблица 7
Электродные потенциалы водородного и кислородного
электродов в различных средах
| pН < 7 | pH = 7 | pH > 7 | |||
| Электрохими-ческая система | 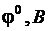
| Электрохими-ческая система | 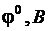
| Электрохими-ческая система | 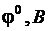
|
| 2H+/H2 | 0 | H2O/OH  ,H2 ,H2
| -0,414 | H2O/OH  ,H2 ,H2
| -0,8281 |
| O2/H+,H2O | 1,229 | O2,H2O/OH 
| 0,815 | O2,H2O/OH 
| 0,400 |
Таблица 8
Стандартные электродные потенциалы и перенапряжения
анодного окисления металлов (при i = 0,001 А/см2)
| Электрохими-ческая система | 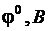
| 
| Электрохими-ческая система | 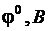
| 
|
| Fe2+/Fe0 | -0,44 | 0,01 | Re3+/Re0 | 0,300 | 0,65 |
| Ni2+/Ni0 | -0,25 | 0,11 | Pd2+/Pd0 | 0,987 | 0,48 |
| Mn2+/Mn0 | -1,180 | 0,5 | In3+/In0 | -0,343 | 0,18 |
| Ag+/Ag0 | 0,7991 | 0,18 | Bi3+/Bi0 | 0,2 | 0,1 |
| Al3+/Al0 | -1,662 | 0,20 | Ga2+/Ga0 | -0,45 | 0,3 |
| Zn2+/Zn0 | -0,763 | 0,03 | Ge2+/Ge0 | 0,0 | 0,1 |
| Pb2+/Pb0 | -0,126 | 0,4 | Hf4+/Hf0 | -1,70 | 0,4 |
| Cr3+/Cr0 | -0,744 | 0,41 | Ir3+/Ir0 | 1,0 | 0,2 |
| Co2+/Co0 | -0,277 | 0,5 | Mo3+/Mo0 | -0,200 | 0,3 |
| Cd2+/Cd0 | -0,4029 | 0,03 | Nb3+/Nb0 | -1,099 | 0,2 |
| Cu2+/Cu0 | 0,337 | 0,06 | Os2+/Os0 | 0,7 | 0,1 |
| Sn2+/Sn0 | -0,136 | 0,01 | Rh3+/Rh0 | 0,80 | 0,04 |
| Sb3+/Sb0 | 0,24 | 0,6 | Ta5+/Ta0 | -1,12 | 0,05 |
| Tc2+/Tc0 | 0,400 | 0,1 | Y3+/Y0 | -2,372 | 0,9 |
| Ti2+/Ti0 | -1,626 | 0,4 | V2+/V0 | -1,186 | 0,35 |
| Tl3+/Tl0 | 0,71 | 0,1 |
Таблица 9
Перенапряжения выделения водорода и ионизации кислорода
на различных металлах (при i = 0,001 А/см2)
| Металл | pН < 7 | pH = 7 | pH > 7 | |||

| 
| 
| 
| 
| 
| |
| Fe | 0,2 | 0,3 | 0,1 | 0,6 | 0,4 | 0,6 |
| Ni | 0,2 | 1,01 | 0,63 | 1,09 | 0,4 | 0,9 |
| Mn | 0,3 | 0,3 | 0,45 | 0,4 | 0,4 | 0,4 |
| Ag | 0,4 | 0,9 | 0,47 | 0,97 | 0,5 | 0,9 |
| Al | 0,4 | 2,0 | 0,80 | 2,5 | 0,6 | 1,6 |
| Zn | 0,3 | 1,5 | 0,72 | 1,75 | 0,5 | 1,4 |
| Pb | 0,5 | 1,2 | 0,52 | 1,445 | 0,5 | 1,1 |
| Cr | 0,4 | 1,1 | 0,5 | 1,205 | 0,6 | 1,2 |
| Co | 0,4 | 1,2 | 0,50 | 1,25 | 0,7 | 1,2 |
| Cd | 0,8 | 1,1 | 0,98 | 1,2 | 0,7 | 1,0 |
| Cu | 0,5 | 1,0 | 0,48 | 1,05 | 0,6 | 1,0 |
| Sn | 0,5 | 1,1 | 0,86 | 1,215 | 0,9 | 1,2 |
| Sb | 0,4 | 0,9 | 0,5 | 1,0 | 0,5 | 1,1 |
| Re | 0,6 | 0,9 | 0,6 | 1,02 | 0,5 | 0,9 |
| Pd | 0,4 | 0,8 | 0,3 | 0,8 | 0,6 | 0,8 |
| In | 0,2 | 0,8 | 0,26 | 0,9 | 0,3 | 0,9 |
| Re | 0,6 | 0,9 | 0,78 | 0,91 | 0,7 | 0,9 |
| Ga | 0,3 | 0,7 | 0,3 | 0,72 | 0,2 | 0,7 |
| Ge | 0,4 | 0,4 | 0,5 | 0,4 | 0,5 | 0,3 |
| Hf | 0,4 | 0,6 | 0,3 | 0,6 | 0,4 | 0,5 |
| Ir | 0,2 | 0,7 | 0,2 | 0,8 | 0,2 | 0,7 |
| Mo | 0,5 | 0,8 | 0,4 | 0,7 | 0,4 | 0,8 |
| Nb | 0,8 | 0,7 | 0,7 | 0,79 | 0,7 | 0,8 |
| Os | 0,2 | 0,8 | 0,2 | 0,81 | 0,1 | 0,8 |
| Rh | 0,2 | 0,82 | 0,2 | 0,90 | 0,2 | 0,81 |
| Ta | 0,1 | 1,2 | 0,3 | 1,50 | 0,1 | 1,4 |
| Tc | 0,3 | 0,9 | 0,4 | 0,92 | 0,3 | 0,9 |
| Ti | 0,4 | 0,69 | 0,5 | 0,70 | 0,4 | 0,78 |
| V | 0,4 | 0,6 | 0,6 | 0,61 | 0,5 | 0,65 |
| Tl | 0,5 | 0,55 | 0,6 | 0,59 | 0,7 | 0,60 |
| Y | 0,1 | 0,61 | 0,3 | 0,62 | 0,1 | 0,63 |
Таблица 10
Значения  некоторых веществ
некоторых веществ
| Формула вещества |  , кДж/моль , кДж/моль
| Формула вещества |  , кДж/моль , кДж/моль
|
| Th(OH)4 (к) | -1585,7 | Mn(OH)2 (к) | -610,85 |
| KIO3 (к) | -714,27 | CdO (к) | -225,21 |
| PbO2 (к) | -219,14 | Fe(OH)2 (к) | -483,87 |
| PbSO4 (к) | -811,78 | HgO (красн.к) | -58,6 |
| H2SO4 (ж) | -724,0 | CuCl (к) | -118,8 |
| ZnSO4 (к) | -871,75 | MgCl2 (к) | -592,73 |
| CdSO4 (к) | -820,57 | Mg(OH)2 | -834,3 |
| H2O (ж) | -237,5 | Ni(OH)2 (к) | -453,43 |
| Cu2Cl2 (к) | -237,8 | CuCl2 (к) | -149,0 |
| MgCl2 (к) | -592,13 | ZnCl2 (к) | -369,51 |
| AgCl (к) | -109,28 | LiOH (к) | -444,22 |
| Ag2O (к) | -10,83 | Pt(OH)2 (к) | -205,54 |
| ZnO (к) | -318,19 | Li2CO3 (к) | -1133,2 |
| Ga(OH)2 (к) | -829,43 | K2SO4 (к) | -1316,37 |
| Cu(OH)2 (к) | -356,90 | Fe(OH)3 (к) | -694,54 |
| Cd(OH)2 (к) | -470,85 | Au(OH)3 (к) | -289,95 |
| Sn(OH)2 (к) | -492,37 | Pb(OH)2 (к) | -421,19 |
ЛИТЕРАТУРА
Основная
Дата добавления: 2018-02-15; просмотров: 1384; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
