ВИЗНАЧЕННЯ ЕЛЕКТРОХІМІЧНОГО ЕКВІВАЛЕНТУ МІДІ
МЕТА

Визначити електрохімічний еквівалент міді.
2 ЗАВДАННЯ
2.1 Зробити дослід.
2.2 Результати дослідів та розрахунків занести до таблиці.
ОБЛАДНАННЯ
3.1 Терези.
3.2 Амперметр.
3.3 Годинник.
3.4 Джерело електричної енергії.
3.5 Реостат, перемикач, з’єднувальні дроти.
3.6 Електролітична ванна із розчином мідного купоросу; дві мідні пластини.
4  ВКАЗІВКИ НА ТЕОРЕТИЧНИЙ МАТЕРІАЛ
ВКАЗІВКИ НА ТЕОРЕТИЧНИЙ МАТЕРІАЛ
4.1 Електроліз.[Л1;§ 19.2]
4.2 Закони Фарадея [Л1; § 19.4,19.5 ]
ТЕОРЕТИЧНІ ПОЛОЖЕННЯ

Процес при якому молекули солей, лугів або кислот розпадаються на заряджені частки (іони) під дією розчинника, називається електролітичною дисоціацією; отриманий при цьому розчин із позитивними і негативними іонами називається електролітом. Якщо у сосуд із електролітом помістити пластини (електроди) з’єднані із джерелом струму (створити в електроліті електричне поле), то позитивні іони будуть рухатись до катоду, а негативні до аноду. У електродів відбуваються окислювально-відновлювальні реакції, при цьому на електродах виділяються речовини-продукти реакції – відбувається електроліз.
Електролізу відповідає Закон Фарадея:
1 Закон: маса речовини, що виділяється на електроді прямо пропорційна кількості електрики Q, що проходить крізь електроліт:
m=k·Q абоm=k·I·t ,
де k - електрохімічний еквівалент речовини. Для кожної речовини k має своє значення. Вимірюючи силу струму в колі, що складено за схемою на рис.1, час його проходження і масу речовини на катоді, можна визначити електрохімічний еквівалент з першого закону Фарадею:  .
.
|
|
|
ПОРЯДОК ВИКОНАННЯ
6.1. Ретельно вимити поверхню мідної пластини, та зважити цю пластину із максимально можливою точністю.
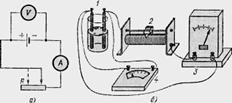 6.2. Зібрати електричне коло за схемою, зображеною на рис. 1. Зважену пластину з’єднати із негативним полюсом джерела електричної енергії.
6.2. Зібрати електричне коло за схемою, зображеною на рис. 1. Зважену пластину з’єднати із негативним полюсом джерела електричної енергії.
6.3. Після перевірки ел. кола викладачем помітити час за годинником, замкнути ключ. Швидко встановити реостатом силу струму 1÷1.5 А. Користуючись реостатом, підтримувати силу струму постійною на протязі всього досліду. Рис.1
6.4. Через 20 хвилин коло розімкнути. Пластину, яка була у досліді катодом, витягнути, промити водою, висушити, ретельно зважити та визначити масу міді.
6.5. За результатом дослідів визначити електрохімічний еквівалент міді 
6.6. Порівняти отримане значення електрохімічного еквіваленту міді з табличним.
| № | Маса катода до досліду m1, кг. |  кг кг
| Маса міді виділеної на катоді m, кг. | Сила струму І, А. | t,c |  , кг/Кл , кг/Кл
| 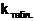 кг/Кл кг/Кл
|
Контрольні питання
|
|
|
6.1 Чому молекули кислоти у воді розпадаються на іони?
6.2 Як змінюється опір електроліту із підвищенням температури? Чому?
6.3  Які вільні носії заряду у електролітах та звідки вони беруться?
Які вільні носії заряду у електролітах та звідки вони беруться?
6.4 Сформулювати закони Фарадея для електролізу.
Висновок
зробити самостійно.
Домашнє завдання
підготуватись до теоретичного опитування.
Дата добавления: 2018-02-15; просмотров: 3950; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
