Физические и химические свойства
Класс алканов
Природными источниками углеводородов являются нефть, природный газ, попутные нефтяные газы, каменный и бурый угли, горючие сланцы, торф. Запасы этих полезных ископаемых на Земле не безграничны.
Однако до настоящего времени они расходуются главным образом в качестве высококалорийного топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные и т.п.). Значительно меньшая часть углеводородного сырья используется в химической промышленности для производства многих полезных и необходимых продуктов.
Алканы (парафины) – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
Алканы — углеводороды, состав которых выражается общей формулой C n H 2n+2, где n – число атомов углерода.
Химическое строение
Связь С–С является ковалентной неполярной. Связь С–Н ковалентная
слабополярная, так как углерод и водород близки по электроотрицательности
(2.5 для углерода и 2.1 для водорода).
Четыре σ-связи углерода направлены в пространстве под углом 109о28',
что соответствует наименьшему отталкиванию электронов.
Поэтому молекула простейшего представителя алканов – метана
СН4 – имеет форму тетраэдра, в центре которого находится атом
углерода, а в вершинах – атомы водорода:
В зависимости от характера отличий в строении изомеров различают
|
|
|
структурную и пространственную изомерию. В ряду алканов
проявляются оба типа изомерии.
Структурные изомеры – соединения одинакового состава, отличающиеся
порядком связывания атомов, то есть химическим строением молекул.
Поворотная изомерия алканов
Характерной особенностью σ-связей является то, что электронная плотность в них распределена симметрично относительно оси, соединяющей ядра связываемых атомов (цилиндрическая или вращательная симметрия).
Поэтому вращение атомов вокруг σ-связи не будет приводить к ее разрыву.
Способность молекул при вращении по σ-связям принимать различные пространственные формы называется поворотной или конформационной изомерией.
Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Некоторые конформации более устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время.
При вращении одной группы СН3 относительно другой возникает множество неодинаковых форм молекулы, среди которых выделяют две характерные конформации (А и Б), отличающиеся поворотом на 60°:
|
|
|
Эти поворотные изомеры этана отличаются расстояниями между атомами водорода, соединенными с разными атомами углерода. В конформации А атомы водорода сближены (заслоняют друг друга), их отталкивание велико, энергия молекулы максимальна. Такая конформация называется "заслонённой", она энергетически невыгодна и молекула переходит в конформацию Б, где расстояния между атомами Н у разных атомов углерода наибольшее и, соответственно, отталкивание минимально. Эта конформация называется "заторможенной", т.к. она энергетически более выгодна и молекула находится в этой форме больше времени
Химические свойства алканов
Химические свойства любого соединения определяются его строением, то есть природой входящих в его состав атомов и характером связей между ними.
Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях, идущих при невысокой темпратуре, и послужила ранее основанием считать их неактивными веществами и назвать парафинами.
|
|
|
1. Крекинг - процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
C n H 2n+2  C m H 2m + C p H 2p+2 , где m + p = n
C m H 2m + C p H 2p+2 , где m + p = n
2. Изомеризация алканов –


3. Дегидрирование алканов - катализатор Ni, Pt, температура, давление

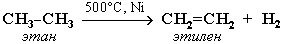

4. Дегидроциклизация - реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.

5. Окисление и частичное окисление
CH4 + 2O2  CO2 +2H2O + 890 кДж
CO2 +2H2O + 890 кДж
C8H18 + 12,5 O2  8CO2 +9H2O + Q
8CO2 +9H2O + Q

6. Р. радикального замещения - галагенирование (свет), нитрование (р. Коновалова)


Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются также синтетические методы.
1. Крекинг нефти (промышленный способ)

2. Гидpиpование непpедельных углеводоpодов:


3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):


4. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода р. Вюрца:
|
|
|


5.Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма)

б) электролиз по Кольбе

6. Разложение карбидов металлов (метанидов) водой:

Применение алканов
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
· Метан в составе природного газа применяется для промышленных синтезов многих продуктов: ацетилена, водорода, хлороформа и других хлорметанов, нитрометана, синильной кислоты, синтез-газа.
· Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве высококалорийного топлива.
· Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
· Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) – пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
· Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
· Паpафин (смесь твеpдых алканов С19-С35) – белая твеpдая масса без запаха и вкуса (т.пл. 50-70 °C) – пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ.
· Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
· Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Класс циклоалканов
Циклоалканы– (циклопаpафины, нафтены, цикланы) - это насыщенные углеводороды, атомы углерода которых замкнуты в цикл. Если молекула содержит только один цикл, то общая формула таких веществ – СnH2n. Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены.
К циклоалканам относятся соединения с разнообразной структурой. Их молекулы могут содержать один цикл (моноциклические алканы) или несколько (полициклические алканы), могут различаться числом атомов углерода в цикле и способом соединения циклов.
Простейший член ряда – циклопропан C3H6

Структурные формулы циклоалканов обычно изображаются сокращенно (без обозначения символов С и Н) в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.
Если молекула циклоалкана содержит заместители, то по правилам международной номенклатуры главной считается цепь углеродных атомов, образующих цикл. При этом нумерацию атомов углерода в кольце проводят так, чтобы ответвления (заместители) получили возможно меньшие номера.
Так, соединение

следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Циклоалканы имеют в своей структуре только одинарные связи, поэтому по своим свойствам сходны с алканами:
малоактивны, горючи, атомы водорода в них могут замещаться галогенами.
Химические свойства циклоалканов и их химическая устойчивость определяются размерами цикла.
· Поэтому циклоалканы с циклами, образованными пятью (циклопентан и его производные) и более атомами углерода, по химическим свойствам напоминают алканы, то есть являются насыщенными.
· Это значит, что для них будут также характерны реакции замещения, элиминирования, расщепления С-С связей.
· Наиболее устойчивыми являются шестичленные циклы (циклогексан и его производные), в которых отсутствуют угловое и другие виды напряжения
· Малые циклы - трех- (циклопропан) и четырехчленный (циклобутан), являясь насыщенными, тем не менее, резко отличаются от предельных углеводородов
Изомерия циклоалканов:
1. Атомы заместителей в циклоалканах с малыми циклами могут находится в цис- или транс-положениях относительно плоскости цикла, поэтому для таких циклоалканов, также как и для соединений с кратной связью, характерна геометрическая изомерия:

2. Изомерия углеродного скелета:
а) кольца

б) боковых цепей

3. Изомерия положения заместителей в кольце:

4. Межклассовая изомерия с алкенами:

4. Оптическая изомерия некоторых ди- (и более) замещенных циклов, в молекулах которых отсутствует плоскость симметрии. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение.

5. Поворотная (конформационная) изомерия. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, то есть более устойчивые. Среди всех циклических структур наименее напряженными являются шестичленные циклы (циклогексан и его производные), в которых существуют весьма устойчивые конформациии с минимальным напряжением.
Взаимные превращения конформаций в циклогексане C6H12 происходят через следующие формы: "кресло" -

конформация "ванна" -

Физические и химические свойства
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур. Циклоалканы практически не растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства циклоалканов в основном сходны со свойствами алканов. Однако, для некоторых представителей есть существенные различия, которые обусловлены размерами цикла.
· Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы С–С–С в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода. Например, отклонение от нормального валентного угла в циклопропане составляет 49°28', что вызывает в цикле большое угловое напряжение α.

Неустойчивость малых циклов определяет их стремление к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан > > циклопентан.
· Циклы, содержащие 5 и более атомов углерода, существуют в неплоских формах, лишенных углового напряжения (ненапряженные или нормальные циклы). Типичным их представителем является наиболее устойчивый 6-членный цикл (циклогексан и его производные). Для ненапряженных циклов характерны реакции замещения, в которых сохраняется циклическая структура.
Реакции малых циклов (С3, С4)
1. Гидрирование (присоединение водорода):

2. Галогенирование (присоединение галогенов):

Хлорирование циклопропана на свету (hν) при температуре выше 100°C также сопровождается разрывом цикла, но в более мягких условиях при температуре ниже 100°C протекает реакция радикального замещения с сохранением цикла:

3. Гидрогалогенирование (присоединение галогеноводородов):

Циклопропан и его гомологи присоединяют хлоро- и бромоводород в водном растворе (газообразные галогеноводороды с циклопропаном не реагируют). Эта реакция характерна только для 3-членных циклов.
Примечание: Циклопропан и его гомологи реагируют с галогенводородами с раскрытием цикла в соответствии с правилом Марковникова.
Реакции ненапряженных циклов (на примере циклогексана)
угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
1. Галогенирование (замещение водорода на галоген)

2. Дегидрирование (отщепление водорода)

Дегидрирование циклогексана и его гомологов лежит в основе процесса ароматизации (риформинга) нефтепродуктов.
Реакция с другими циклоалканами (C5, C7 и т.д.) приводит к образованию циклоалкенов.
Реакции окисления
1. Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:

Получение адипиновой кислоты имеет важное промышленное значение - используется в производстве синтетического волокна - нейлона.
2. Горение в контакте с открытым пламенем
2СnH2n + 3nO2  2nCO2 + 2nH2O + Q
2nCO2 + 2nH2O + Q
Газообразные и низкокипящие циклоалканы образуют
с кислородом или воздухом взрывоопасные смеси.
3. Практическое значение имеют реакции направленного окисления циклогексана. В зависимости от условий при этом получают ряд ценных продуктов. При окислении без разрыва связей С–С получают циклические продукты (спирт и кетон):

Циклогексанон применяется для производства
капролактама и синтетического волокна капрон.
Получение и применение
1. Основной способ получения циклоалканов — отщепление двух атомов галогена от дигалогеналканов:

2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,P,Ni
C6H6 + 3H2 → C6H12.
3. Циклогексан и его гомологи получают каталитическим гидрированием бензола и его алкильных производных, являющихся продуктами нефтепереработки.

4. Циклопентан и его гомологи образуются при каталитическом дегидрировании алканов, содержащих 5 (но не более) атомов углерода в основной цепи:

Циклопарафины находят широкое применение в разных областях народного хозяйства.
Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Циклопентан используется в органическом синтезе и как добавка к моторному топливу для повышения качества.
Циклогексан используется для синтеза полупродуктов при производстве синтетических волокон нейлона и капрона, для получения циклогексанола, циклогексанона, адипиновой кислоты, а также в качестве растворителя.
В нефтехимической промышленности нафтены используются для получения ароматических углеводородов путем каталитического крекинга.
Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений (более 200 наименований).

Этилен применяется как средство, в атмосфере которого происходит ускоренное созревание фруктов и овощей.
Пропилен в промышленности применяется, в основном, для синтеза полипропилена. Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.


Полипропилен по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Волокно из полипропилена прочнее всех известных синтетических волокон.
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10-С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
Алкадиены
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов С n H 2n-2.
Сопряжённые диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.
Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ
Номенклатура алкадиенов
По правилам систематической международной номенклатуры главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется cуффиксом –диен (или, точнее, суффикс –ан заменяется суффиксом –адиен: пропан → пропадиен, бутан → бутадиен, алкан → алкадиен). Можно также исходить из названия соответствующего алкена, указав наличие двух двойных связей добавлением к суффиксу ен символа удвоения ди, например, бутен → бутадиен.
Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия.
Например:

Название "дивинил" происходит от названия радикала –СН=СН 2 "винил".

Тривиальные названия изопрен (2-метилбутадиен-1,3) и аллен (пропадиен-1,2) разрешены правилами международной номенклатуры ИЮПАК.
Дата добавления: 2021-06-02; просмотров: 314; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
