Слайд 8. Квадридентный лиганд
Квадридентный лиганд имеет четыре неподелённых пары, каждая из которых может связываться с центральным ионом металла. Примером такого случая является гемоглобин.
Функциональная часть гемоглобина — ион железа (II), окруженный сложной молекулой, называемой гемом. Это своего рода полое кольцо из атомов углерода и водорода, в центре которого находятся четыре атома азота с неподелёнными парами на них.
Гем является одним из группы подобных соединений, называемых порфиринами. Все они имеют одинаковую кольцевую систему, но с разными группами, прикреплёнными к внешней стороне кольца. Не будем рассматривать точную структуру. Рассмотрим упрощённую схему гема с захваченным ионом железа:
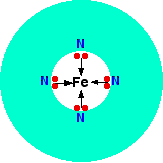
Рис. 8. Упрощённая структура гема с захваченным ионом железа
Каждая из неподелённых пар на азоте может образовывать координационную связь с ионом железа (II), удерживая его в центре сложного кольца атомов.
Слайд 9. Железо образует четыре координационные связи с гемом, но также есть место для образования ещё двух - одну над и другую под плоскостью кольца.
Белковый глобин прикрепляется к одному из этих положений с помощью неподелённой пары на одном из атомов азота в одной из его аминокислот. Интересно и другое положение.

Рис. 9. Строение гемоглобина
В целом комплексный ион имеет координационное число 6, потому что центральный ион металла образует 6 координационных связей.
|
|
|
Молекула воды, которая связана с нижней позицией на диаграмме, легко заменяется молекулой кислорода (опять же через неподелённую пару на одном из атомов кислорода в O2) - и именно так кислород переносится по крови гемоглобином.
Когда кислород попадает туда, где он нужен, он отрывается от гемоглобина, который возвращается в лёгкие, чтобы получить ещё немного кислорода.
Вы, наверное, знаете, что окись углерода (угарный газ) ядовита, потому что вступает в реакцию с гемоглобином. Он связывается с тем же участком, который в противном случае использовался бы кислородом, но образует очень стабильный комплекс. Окись углерода больше не отрывается, и это делает молекулу гемоглобина бесполезной для дальнейшего переноса кислорода.
Слайд 10. Гексадентатный лиганд
Гексадентатный лиганд имеет 6 неподелённых пар электронов, все из которых могут образовывать координационные связи с одним и тем же ионом металла. Лучший пример — ЭДТА.
ЭДТА используется как отрицательный ион — ЭДТА4-. На схеме показана структура иона с выделенными важными атомами и неподелёнными парами.
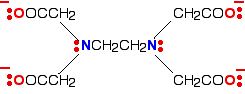
Рис. 10. Ион ЭДТА4-
Слайд 11. Ион ЭДТА полностью покрывает ион металла, используя все 6 позиций, которые мы видели ранее. Координационное число снова равно 6 из-за того, что шесть координационных связей образованы центральным ионом металла. На диаграмме ниже показано, как это происходит с ионом железа (III).
|
|
|

Рис. 11. Ион [Fe(ЭДТА)]-
Общий заряд равен 1-: на исходном ионе железа (III) 3+ и 4- на ионе ЭДТА4-.
Дата добавления: 2021-06-02; просмотров: 47; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
