Слайд 7. Сложные ионы металлов, содержащие более сложные лиганды
Часть 1. Комплексные соединения. Общие понятия
Слайд 1. Железо считается одним из важнейших элементов для роста и развития человеческого организма. Железо необходимо для правильного функционирования нашей иммунной системы. В этой лекции мы подробно рассмотрим, насколько важно железо для нормального обмена веществ и какие последствия может иметь дефицит железа для нашего здоровья. Мы также обсудим возможные способы предотвращения развития таких недостатков и доступные методы лечения. Для начала рассмотрим структуру комлпексов железа.
Слайд 2. Что такое комплексный ион металла?
В центре сложного иона находится ион металла, а вокруг него находится ряд других молекул или ионов. Их можно считать присоединёнными к центральному иону координационными (дативными ковалентными) связями. (В некоторых случаях соединение на самом деле более сложное.)
Молекулы или ионы, окружающие центральный ион металла, называются лигандами. Исходя из этого можно дать определение, что такое комплекс. Комплекс — это центральный атом, окружённый набором лигандов. Совокупность центральных атомов и всех лигандов называется координационной сферой.
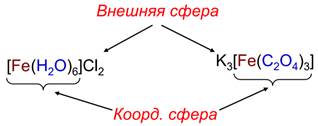
Рис. 1. Строение комплекса
Соединения, содержащие одну или несколько координационных сфер, называются комплексными.
Слайд 3. Природа лигандов
Простые лиганды включают воду, аммиак и ионы хлора.
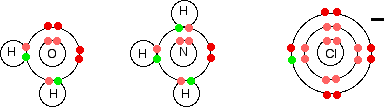
Рис. 2. Лиганды: молекула воды, аммиака и ион хлора
|
|
|
Все это объединяет активные неподелённые пары электронов на внешнем энергетическом уровне. Они используются для образования координационных связей с ионом металла.
Все лиганды являются донорами неподелённой пары. Другими словами, все лиганды действуют какоснования Льюиса.
Слайд 4. Связывание простых сложных ионов
Мы собираемся подробно рассмотреть связь в комплексном ионе Fe(H2O)63+, содержащем переходный металл и образующемся, когда молекулы воды присоединяются к иону железа.
Для начала рассмотрим структуру «голого» иона железа до того, как к нему прирсоединятся молекулы воды.
Железо имеет электронную структуру
1s22s22p63s23p63d64s2
Когда он образует ион Fe3+, он теряет 4s-электроны и один из 3d-электронов
1s22s22p63s23p63d5
Рассмотрим энергетические уровни как электроны в ящиках:
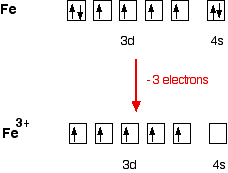
Рис. 3. Энергетические уровни железа
Внимание! Одиночные электроны на 3-м уровне никак не участвуют в связывании. Вместо этого ион использует 6 орбиталей с уровней 4s, 4p и 4d, чтобы принимать неподелённые пары от молекул воды.
Слайд 5. Перед использованием орбитали реорганизуются (гибридизируются) для получения 6 орбиталей с одинаковой энергией. Тип гибридизации АО Fe3+: d2sp3
|
|
|
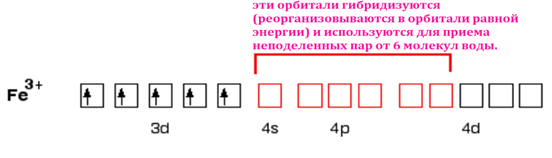
Рис. 4. Гибридизация орбиталей железа
Слайд 6. На каждой молекуле воды показана только одна неподелённая пара. Другая неподелённая пара направлена в сторону от железа и поэтому не участвует в образовании связи. Полученный октаэдрический ион выглядит так:
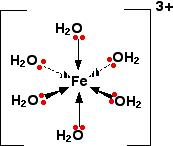
Рис. 5. Строение иона Fe(H2O)63+
Поскольку железо образует 6 связей, координационное число железа равно 6.
Примечание: этот пример был выбран намеренно, чтобы избежать осложнений. Со многими лигандами электроны на 3-х уровнях перемещаются до того, как образуются координационные связи.
Например, если используются цианид-ионы CN- в качестве лигандов вокруг иона железа (III), d-электроны образуют две пары плюс одна - вместо того, чтобы все быть одиночными. Поскольку при этом образуются две пустые 3d-орбитали, это влияет на то, какие орбитали гибридизуются, готовые к образованию связей с лигандами.
Это информация для высшего уровня. Всё, что необходимо знать, это то, что лиганды связываются, образуя координационные связи, используя доступные пустые орбитали в ионе металла.
Слайд 7. Сложные ионы металлов, содержащие более сложные лиганды
В примере, который мы уже рассмотрели, каждый лиганд образовывал только одну связь с центральным ионом металла, давая комплексный ион. О таком лиганде говорят, что он неидентичный. У него есть только одна пара электронов, которую он может использовать для связи с металлом - любые другие неподелённые пары указывают в неправильном направлении.
|
|
|
Однако у некоторых лигандов пар электронов гораздо больше. Они обычно известны как полидентатные или полидентатные лиганды, но их можно разделить на несколько различных типов.
Бидентатные лиганды
Бидентатные лиганды имеют две неподелённые пары, каждая из которых может связываться с центральным ионом металла.
Двумя наиболее часто используемыми примерами являются 1,2-диаминоэтан (старое название: этилендиамин) и этандиоат-ион (старое название: оксалат).
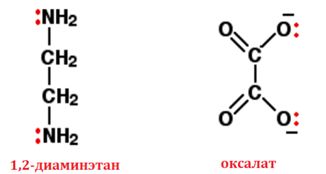
Рис. 6. Формулы: слева - 1,2-диаминэтана, справа - оксалат-иона
В этандиоат-ионе намного больше неподелённых пар, чем показано, но это единственные, которые нас интересуют.
Эти бидентатные лиганды можно представить как пару наушников, несущих одиночные пары на каждом из «наушников». Тогда они будут плотно прилегать к иону металла.
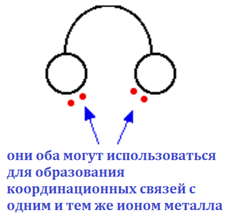
Рис. 7. Бидентантные лиганды
Дата добавления: 2021-06-02; просмотров: 53; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
