Уравнение Менделеева-Клапейрона
Год
Пара – лекция
Группы 19-СБ-СТ2, 19-СБ-СТ4, 19-СБ-СТ5
Раздел: Молекулярная физика и термодинамика
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул.
Молекула – наименьшая частица вещества, состоящая из атомов и обладающая его основными химическими свойствами.
Экспериментальные подтверждения молекулярного строения вещества:
- броуновское движение;
- диффузия.
Основные положения молекулярно-кинетической теории (МКТ):
1. Вещество состоит из молекул (молекулы из атомов).
2. Все молекулы взаимодействуют друг с другом (притягиваются, отталкиваются).
3. Все молекулы находятся в непрерывном хаотичном движении.
Агрегатное состояние вещества и его поведение характеризуется силами притяжения между молекулами (атомами), энергией хаотического теплового движения и концентрацией молекул (атомов).
Твёрдые тела: концентрация молекул большая, доминируют силы притяжения. Твёрдые тела сохраняют свои размеры и форму (имеют и собственный объём, и собственную форму).
Жидкости: концентрация молекул меньше, сила притяжения между ними – тоже. Сохраняют свой объём, принимают форму сосуда (имеют свой объём, но не имеют своей формы).
Газ: концентрация молекул мала, силы взаимодействия малы. Газ занимает весь предоставленный ему объём (не имеет ни своего объёма, ни своей формы).
|
|
|
Молекулярная физика – раздел физики, в котором изучаются строение и свойства вещества, исходя из молекулярно-кинетических представлений.
Атомное строение вещества: сторонники – Демокрит (древнегреческий философ), М.В. Ломоносов, Р. Клаузиус, Д. Максвелл, Л. Больцман.
Основной метод молекулярной физики – статистический.
Термодинамика (ТД) – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамический метод базируется на двух началах – фундаментальных законах, установленных в результате обобщения опыта.
Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами.
Термодинамические параметры – совокупность физических величин, характеризующих свойства термодинамической системы.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Термодинамическая температурная шкала определяется по одной реперной точке:
|
|
|
Лёд, вода, насыщенный пар при р=609 Па – тройная точка воды (273,16 К или 0 оС).
Связь между температурой по шкале Кельвина и Цельсия:
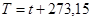 .
.
Нуль кельвин (абсолютный ноль) – недостижимая температура, к ней можно только приблизиться.
Удельный объём – объём единицы массы:
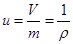 .
.
Термодинамический процесс – изменение термодинамической системы, где изменяются термодинамические параметры (или хотя бы один из них).
Идеальный газ – простейшая модель реального газа. Его свойства:
1. Собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда.
2. Между молекулами газа отсутствуют силы взаимодействия (потенциальная энергия взаимодействия равна нулю).
3. Молекулы ведут себя как абсолютно упругие шары.
Законы идеального газа
Выполняются только для постоянной массы газа.
1. Закон Бойля Мариотта – для изотермического процесса (т.е. 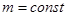 ,
, 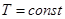 ):
): 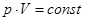 .
.

2. Законы Гей-Люссака:
а) объём данной массы газа при постоянном давлении изменяется линейно с температурой:
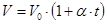

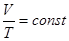 .
.
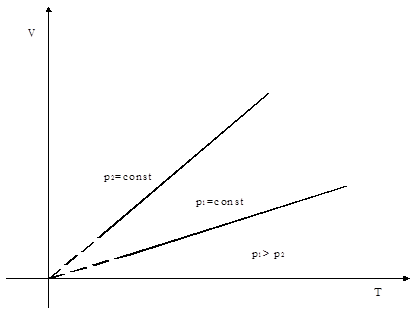
б) давление данной массы газа при постоянном объёме изменяется линейно с температурой:
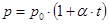
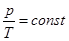 .
.
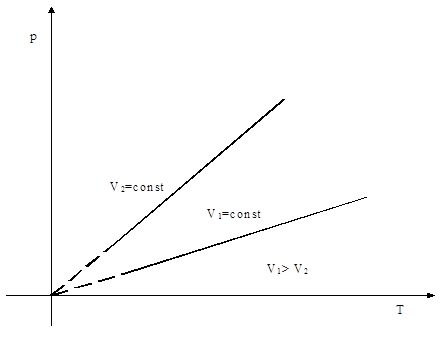
Закон Авогадро: один моль любого газа при одинаковой температуре и давлении занимает одинаковый объём.
|
|
|
Один моль различных веществ содержит одно и то же количество молекул и называется постоянной Авогадро:
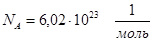 .
.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в неё газов:
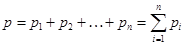 .
.
Парциальное давление – давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Уравнение Менделеева-Клапейрона
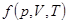 – уравнение состояния идеального газа.
– уравнение состояния идеального газа.
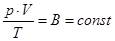 – для данной массы газа.
– для данной массы газа.
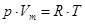 – уравнение состояния идеального газа.
– уравнение состояния идеального газа.
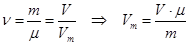
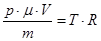
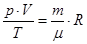 – уравнение Менделеева-Клапейрона.
– уравнение Менделеева-Клапейрона.
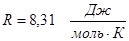 – универсальная газовая постоянная.
– универсальная газовая постоянная.

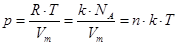
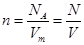
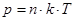 – уравнение МКТ.
– уравнение МКТ.
Основное уравнение МКТ
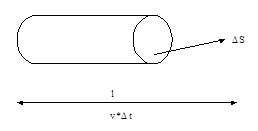
При каждом соударении молекула, движущаяся перпендикулярно площадке, передаёт импульс 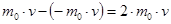 (аргументы – соответственно масса и скорость молекулы).
(аргументы – соответственно масса и скорость молекулы).
За время 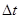 площадки
площадки 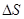 достигнут только те молекулы, которые заключены в объёме цилиндра с основанием
достигнут только те молекулы, которые заключены в объёме цилиндра с основанием 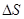 и высотой
и высотой 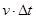 . Число этих молекул равно
. Число этих молекул равно 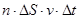 .
.
Пространство трёхмерно, движение молекул происходит в прямом и противоположном направлениях.
Число ударов молекул о площадку 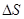 составит:
составит:  .
.
Импульс молекул:
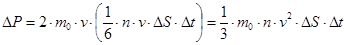 .
.
Давление газа:
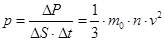 .
.
Средняя квадратичная скорость характеризует всю совокупность молекул газа: 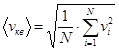 .
.
|
|
|
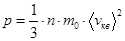 – основное уравнение МКТ идеальных газов.
– основное уравнение МКТ идеальных газов.
Но 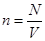 , где N – число молекул в объёме V.
, где N – число молекул в объёме V.
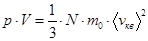

Здесь: Е – суммарная кинетическая энергия всех молекул.
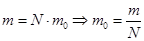
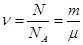
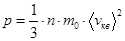
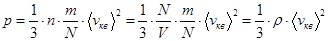
Какова связь между абсолютной температурой и среднеквадратичной скоростью молекул идеального газа?
С одной стороны, 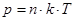 .
.
С другой стороны, 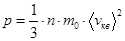 .
.
Приравнивая, получаем: 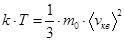 .
.
Отсюда 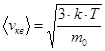 .
.

Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
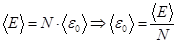
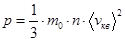
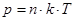
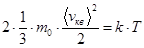

Отсюда 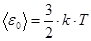 .
.
Дата добавления: 2021-06-02; просмотров: 43; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
