Схема разделения катионов на аналитические группы.
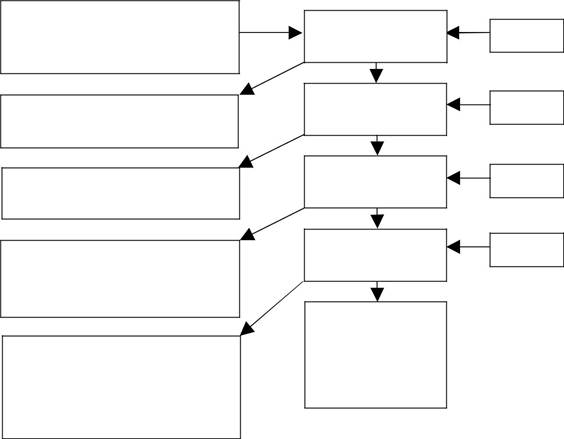
Предварительные испытания на катионы I группы:
Na+, K+,
Осадок хлоридов II группы:
AgCl, Hg2Cl2, PbCl2
Осадок сульфатов III группы:
CaSO4, SrSO4, BaSO4, PbSO4
Раствор соединений IV группы:
Раствор аммиакатов катионов VI группы: ,
Раствор катионов I – VI группы
Раствор катионов III – VI группы
Раствор катионов IV – VI группы
Раствор катионов V – VI группы
Осадок катионов V группы:
Mg(OH)2,
Mn(OH)2, HSbO2,
HSbO3
HCl
H2SO4
NaOH
NH4OH
Аналитическая классификация анионов
Анализ анионов существенно отличается от анализа катионов, основанного на последовательном делении катионов на группы с помощью групповых реакций.
Для обнаружения большинства анионов чаще всего возможен дробный метод. Кроме того, окислительно-восстановительные и комплексообразую-щие свойства анионов приводят к тому, что многие из них не могут находиться в растворе одновременно или в присутствии некоторых катионов из-за идущих между ними реакций. Например, S 2- и NO3- ; I - и H2 AsO4- и др.
Тем не менее, для упрощения анализа анионов предлагаются классифи-кации, основанные на использовании разных реактивов в качестве групповых.
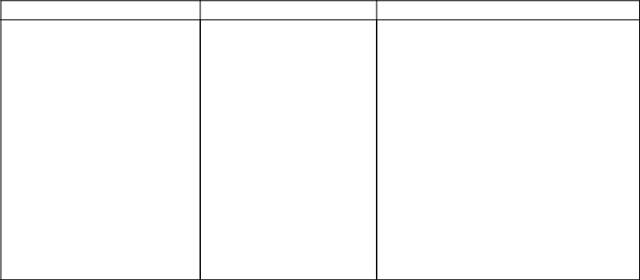
| Взаимодействие BaCl2 и AgNO3 с отдельными ионами | Таблица 4 | ||||||
| Анионы | BaCl2 | AgNO3 | |||||
| без подкисления | при подкислении | без подкисления | при подкислении | ||||
| I группа | |||||||
| Cl- | -
| - | AgCl↓ | AgCl↓ | |||
| Br- | |||||||
| белый | белый | ||||||
| I- | - | - | AgBr↓ | AgBr↓ | |||
| желтоватый | желтоватый | ||||||
| - | - | AgI↓ | AgI↓ | ||||
| светло-желтый | светло-желтый | ||||||
| II группа | |||||||
| SO2- | |||||||
| 4 | |||||||
| CO 2- | BaSO4↓ | BaSO4↓ | - | - | |||
| 3 | белый | белый | |||||
| PO3- | BaСO3↓ | - | Ag2CO3↓ | - | |||
| белый | Белый | ||||||
| 4 | |||||||
| BaНРO4↓ | - | Ag3РO4↓ | - | ||||
| белый | Желтый | ||||||
| IIIгруппа | - | - | |||||
| NO - | |||||||
| 3 | |||||||






Также используется классификация анионов по окислительно-восстано-вительным свойствам (табл. 5).
|
|
|
Таблица 5
Классификация анионов по окислительно-восстановительным свойствам Анионы  Групповой реагент
Групповой реагент  Характеристика группы
Характеристика группы
Первая группа – окислители:
| NO3-, MnO4-, CrO42-, | KI | Выделяют свободный йод I2 из KI | |||||
| NO-, | O2- | в кислой среде | при подкислении 2н раствором | ||||
| 2 | 2 | H2SO4 | |||||
|
| |||||||
| Вторая группа – | |||||||
| восстановители: | KMnO4 | Обесцвечивают 0,1н раствор KM- | |||||
| Cl -, Br -, | I -, S 2-, SO | 2- , | |||||
| S O2-, | 3 | в кислой среде | nO4при подкислении 2н раствором | ||||
| C O2- | |||||||
| 2 | 3 | 2 | 4 | H2SO4 | |||
|
| |||||||
| Третья группа: | - | В условиях анализа не участвуют в | |||||
| SO42-, CO32-, PO43-, | |||||||
| CH | COO-, SiO2- | окислительно-восстановительных | |||||
| 3 | 3 | реакциях | |||||
|
|
|
Чаще всего для этого используют различия в растворимости бариевых и серебряных солей (табл. 5).
Контрольные вопросы
Письменно отвечать не нужно, проконтролируйте себя, насколько Вы усвоили материал
1. С какой целью проводится качественный анализ
2. Определите понятие «аналитический эффект»
3. Требования к аналитическим реакциям
4. Дайте определения избирательности, селективности, специфичности аналитической реакции
5. Какие величины характеризуют чувствительность аналитической реакции
6. Назовите методы проведения качественного анализа
7. В чем заключаются систематический и дробный способы анализа
8. На чем основана кислотно-основная схема разделения катионов
9. Определите понятие «групповой реагент»
10. Какие катионы входят в каждую аналитическую группу катионов?
11. На чем основана классификация анионов?
Дата добавления: 2021-06-02; просмотров: 169; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
