Качественный анализ катионов. Аналитическая классификация катионов
Раздел 2:Химические методы анализа
Основная задача химического анализа - определение качественного и количественного состава веществ и их структуры
Классификация методов химического анализа:
· -по цели анализа
-качественный
-количественнымй.
Анализ любого вещества всегда начинается с его идентификации, то есть определения качественного состава, что определяет, к какой группе веществ его отнести; только после этого проводится количественный анализ (определяется содержание интересующих компонентов в анализируемом материале).
Количественный анализ определяет общее содержание элементов в пробе, содержание главных элементов и затем содержание примеси.
· в зависимости от массы вещества:
-макроанализ (для анализа берут 0,1-1 г);
-полумикроанализ (0,01-0,1 г);
-микроанализ (0,001-0,01 г);
-ультрамикроанализ (0,0001-0,001 г);
-субмикроанализ (0,00001-0,0001 г).
В химическом анализе используют химические реакции, которые называют аналитическими
Требования к аналитическим реакциям:
-должны протекать с достаточной скоростью (практически мгновенно)
-дожны быть практически необратимы
-не должны иметь побочных реакций
-должны иметь видимый эффект (изменение окраски, выделение газа, выпадение осадка, изменение окраски индикатора)
В ряде случаев, если не удается выбрать достаточно чувствительную реакцию, проводят дополнительно физические испытания, например, спектральный анализ.
|
|
|
Качественный химический анализ выполняется с применением аналитических реакций для конкретных определяемых компонентов. Эти реакции называют качественными (частными)
Количественные определения выполняются двумя классическими химическими методами:
-гравиметрический (весовой) метод анализа
-титриметрический (объемный) метод анализа
Тема: Качественный химический анализ
Учебник А.А.Ищенко «Аналитическая химия» стр.72-128
Методы качественного анализа
Первоначальная задача при исследовании любого материала – его качественный анализ на содержание наиболее распространенных неорганических ионов, поскольку знание элементного состава исследуемого материала и степенней окисления присутствующих элементов во многом определяет его структуру и свойства.
Задачи качественного химического анализа – обнаружение в исследуемом образце и идентификация строго определенных компонентов: химических элементов или ионов, функциональной группы или какого- либо конкретного химического вещества. Этот анализ осуществляется как с помощью химических реакций, так и в результате наблюдения некоторых физических свойств веществ. В ходе его так же можно приблизительно оценить содержание этого вещества в образце: большое, малое, очень малое, следы.
|
|
|
Аналитические реакции
|
|
| Способность реакции показывать аналитический эффект при очень малых содержаниях определяемого вещества. Чувстви-тельность реакции характеризуют: открываемый минимум, пре-дел обнаружения, произведение растворимости. |
| Минимальное количество вещества, [мкг], которое может быть открыто (выявлено) в минимальном объеме пробы (в одной кап-ле раствора). |
| Минимальная концентрация вещества, [мкг/мл, мг/л, моль/л, % и т.д.], при которой аналитическая реакция дает положительный эффект. |
| Произведение концентраций ионов [Mm+] и [Аа-], [моль/л], нахо-дящихся в равновесии с осадком МаАm: |
| ПРМаАm = [Mm+]а · [Аа-]m |
| Способность реакции давать аналитический эффект с ограничен-ным числом веществ (наивысший случай селективности – специ-фичность, когда аналитический эффект возникает только при на-личии одного единственного вещества). |
| Реактивы, используемые для разделения изучаемых ионов на аналитические группы. Реакции, применяемые для открытия отдельных ионов, называются характерными. |
| 27 | |||||||||
| Примеры аналитических реакций
| Таблица 1 | ||||||||
| Реакции, | Примеры | Аналитический | Примеры | ||||||
| процесс | уравнений реакций | эффект | открываемых | ||||||
| ионов и веществ | |||||||||
| Осаждения | Ba+2+ | SO42- | = | BaSO4¯ | Образование белого | Ba+2, SO42- | |||
| осадка | |||||||||
| Кислотно-основ- | CO2-+2H | O+ | = CO - +3 | Выделение пузырьков | CO 2- | ||||
| ные | 3 | 3 | 2 | газа | 3 | ||||
| Окислительно- | Mn+2+ | 2H | O = MnO ¯ + | Образование темно-ко- | Mn+ 2 | ||||
| восстановительные | 2 | 2 | 2 | ричневого осадка | |||||
| Комплексообразо- | Fe+3+3SCN - | = Fe(SCN ) | Появление красной | Fe+3 | |||||
| вания | окраски раствора | ||||||||
| Этерификации | CH3COOH + C2H5OH = | Появление запаха гру- | CH 3COOH | ||||||
| = CH3COOC2H5 + H2O | ши | ||||||||
| Экстракции | I2(водн.) + C6H6 = I2(орг.) | Фиолетовый экстракт | I 2 | ||||||





Для качественного анализа пригодны только те реакции, которые сопровождаются заметным, характерным только для этого вещества, изменением реакционной смеси – аналитическим эффектом. Аналитическим эффектом может быть появление (или исчезновение) осадка, окраски, выделениегазов, способность экстрагироваться несмешивающимся с водой растворителем, характерной окраской пламени при внесении в него испытуемой пробы и т.п. В качестве таких реакций могут быть взяты реакции разных типов, примеры – в табл. 2. Кроме того качественная реакция должна обладать высо-кой чувствительностью и селективностью (табл.2).
|
|
|
Таблица 2
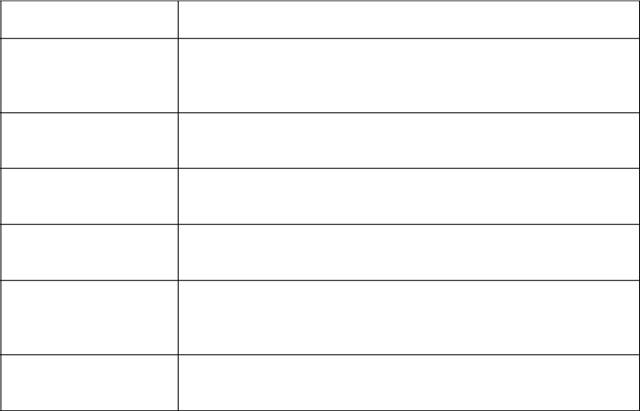 Основные понятия и определения качественного анализа Основные понятия - Определения
Основные понятия и определения качественного анализа Основные понятия - Определения
Чувствительность ана-литической реакции
Открываемый мини-мум (ОМ)
Предел обнаружения (ПрО)
Произведение раство-римости осадка (ПРМа-
Аm)
Селективность анали-тической реакции
Групповые реагенты
28
Если содержание вещества в пробе меньше, чем ОМ или ПрО, то это вещество может остаться не открытым, и необходимо искать более чувствительную реакцию (с меньшим значением произведения растворимости) или прибегнуть к какому-либо способу концентрирования раствора (например, к упариванию, сорбции, экстракции), чтобы концентрация раствора превысила ПрО.
· Методы проведения качественного анализа
Для проведения качественногоанализа используют систематический идробный методы.
Систематический метод идентификации основан на переведении пробы в раствор, разделении смеси ионов на группы и подгруппы с помощью групповых реагентов, а затем в пределах этих групп обнаружении отдельных ионов характерными реакциями. Такой способ позволяет значительно увеличить количество получаемой аналитической информации и повысить ее надежность.
Дробный метод основан на непосредственном определении данного элемента или иона в объекте с помощью качественной реакции. Обнаружение иона осуществляется в два приема: сначала из раствора устраняются (маскируются) мешающие ионы, а затем с помощью характерной реакции осуществляется обнаружение определяемого иона.
На практике используют оба метода и по отдельности, и в сочетании. Для определения катионов обычно предпочитают проводить систематический качественный анализ, а для определения анионов – дробный.
Группы реагентов (групповые реагенты)- это реагенты (химические вещества), взаимодействующие с определенной группой ионов с одинаковым или близким аналитическим эффектом, и позволяющие отделить одну группу ионов от другой (групповые реагенты разделения).
Основное назначение групповых реагентов – предварительное разделение смеси ионов на меньшие по составу группы путем перевода части ионов в осадок.
Групповые реагенты, применяемые в качественном анализе:
-общие: реагируют преимущественно со всеми ионами (например: ще-лочи, гидроксид аммония, анионы сильных и слабых кислот, цинк);
-групповые: взаимодействуют более чем с тремя ионами;
-специфические или характерные для данного иона: действуют только на определенный ион.
· Способы проведения аналитических реакций: «сухой» и «мокрый». При «сухом» способе реагенты берут в твердом состоянии: реакции рас-
тирания порошков; получение стекловидных шариков при плавлении небольших количеств анализируемого вещества с бурой или дигидрофосфатом аммония; окрашивание пламени.
При «мокром» способе предварительно растворяют реагенты в воде, кислоте или щелочи и аналитические реакции проводят, вводя в исследуемый раствор определенные реактивы, дающие с открываемым ионом характерный продукт взаимодействия.
К мокрым способам анализа относят все виды определений, при которых анализируемое вещество предварительно переводят в раствор. Это такие методы, как: пробирный анализ, капельный, экстракционный и микрокристаллоскопический. В качестве растворителя чаще всего используют воду, реже – органические растворители (CCl4, бензол, спирты и эфиры) из-за их летучести и токсичности.
Пробирный анализ выполняют в цилиндрических пробирках объемом 5 – 10 мл, в которые отбирают примерно 0,5 – 1 мл анализируемого раствора и добавляют по каплям реагент. Так как большинство реакций очень чувствительны и протекают с высокой скоростью, то в среднем добавляют 3 – 5 капель реагента, которых вполне достаточно для появления четкого аналитического признака. При необходимости анализ может выполняться с нагревом на водяной или песочной бане, или на газовой горелке.
Капельный анализ является методом химического анализа, в котором один или все компоненты реакции (обычно рассматриваемая субстанция) используется в виде капли. Анализ капельный начали использовать достаточно давно использование капельных реакций на бумаге для аналитических целей известно с 1834, а 1920 российский ученый М.А. Тананаев разработал капельный метод анализа в аналитической химии, в частности обосновал его теорию и практику.
Основные особенности капельного анализа заключаются в использовании наиболее характерных и чувствительных реакций при очень малом расходе веществ-реагентов и времени для анализа (при приблизительно в 3-10 раз меньше, в сравнении с пробирочным методом анализа), а также простоте оборудования.
Микрокристаллоскопический анализ основан на идентификации ионов по цвету и форме кристаллов. Он предложен академиком Ловиц Т. Е. в 1798 г. Реакцию проводят на предметном стекле, куда наносят каплю исследуемого препарата и реагента. Рост кристаллов и их окраску наблюдают в микроскоп и сравнивают с образцами в определителях. При необходимости ускорения роста кристаллов препарат слегка подсушивают.
29
Качественный анализ катионов. Аналитическая классификация катионов
При анализе образцов, содержащих достаточно большое число видов разнообразных катионов, их взаимное мешающее действие не позволяет использовать дробный метод анализа. В этом случае используют систематический анализ, чтобы предварительно разделить эти ионы на более мелкие группы с помощью подходящих групповых регентов, а затем определять отдельные виды катионов внутри каждой группы.
Аналитическая классификация катионов на группы проводится не по всей совокупности химических свойств элементов, а по небольшому числу выбранных свойств конкретных ионов, которые определяют конкретную специфику их качественного анализа.
В каждом отдельном случае, исходя из определенных частных соображений, выбирают свойства катионов для распределения их на группы. В результате созданы разные классификации катионов и, как следствие этого, разные схемы анализа:
-кислотно-основная,
-сероводородная,
-аммиачно-фосфатная, т
-тиоацетамидная и др.
Каждая из этих схем анализа обладает определенными достоинствами и недостатками, но в конечном итоге при тщательном выполнении все они дают правильные результаты.
В основу кислотно-основной схемы качественного анализа положено разное отношение катионов к действию на них кислот и оснований (H2SO4, HCl,NaOH,NH4OH)
В соответствии с их действием выделены шесть групп катионов.
| Аналитическая классификация катионов по кислотно-основной схеме | Таблица 3 | |||
| Гру | Катионы | Группо- | Примечание | |
| ппы | вой реа- | |||
| гент | ||||
| Na +, K +, NH 4+ | Эти катионы в большинстве случаев образуют хорошо | |||
| I | - | растворимые соли и группового реагента не имеют. | ||
| Ag+, Hg22+, | Эти катионы образуют малорастворимые хлориды. | |||
| II | Pb2+ | HCl | Наибольшее значение произведения растворимости у | |
| PbCl2 (1,6 · 10-5), поэтому часть ионов Pb2+ остается в | ||||
| растворе и в ходе систематического анализа попадает в | ||||
| III группу. | ||||
| III | Ca2+, Sr2+, Ba2+, | H2SO4 | Эти катионы образуют малорастворимые сульфаты. | |
| Pb2+ | Наибольшей растворимостью обладает CaSO4 (ПР = 2,5 | |||
| · 10-5). Для снижения растворимости следует добавлять | ||||
| равный объем этилового спирта. | ||||
| IV | Al3+, Cr3+, Zn2+, | NaOH | Эти катионы образуют амфотерные гидроксиды или | |
| As3+, As5+, Sn2+, | растворимые соли кислородсодержащих кислот и | |||
| Sn4+ | поэтому хорошо растворяются в избытке щелочей. | |||
| V | Bi3+, Fe3+, Fe2+, | NaOH | Эти катионы образуют малорастворимые гидроксиды | |
| Mg2+, Mn2+, | или кислородсодержащие кислоты. | |||
| Sb3+, Sb5+ | ||||
| VI | Cd2+, Co2+, Cu2+, | NH4OH | Эти катионы образуют прочные растворимые в воде | |
| Ni2+, Hg2+ | аммиакаты, в результате образования которых не- | |||
| растворимые гидроксиды легко переходят в раствор. | ||||





В соответствии с кислотно-основной классификацией систематический ход качественного анализа смеси катионов можно представить схемой:
Дата добавления: 2021-06-02; просмотров: 719; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
