Метод обращения полярности Кори – Зеебаха
Альдегиды и кетоны при взаимодействии с тиолами в присутствии кислот Льюиса образуют тиоацетали (тиокетали). Наибольшее распространение в качестве каталитической системы нашел эфират трехфтористого бора. Среди тиоацеталей в современном органическом синтезе совершенно исключительное положение занялшестичленный циклический 1,3-дитиан, получаемый из формальдегида и 1,3-пропандитиола, как показано на схеме 7.32.
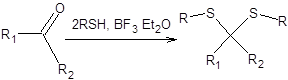
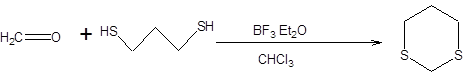
Схема 7.32
1,3-Дитиан предоставляет уникальные синтетические возможности, связанные с его способностью нацело превращаться в карбанион под действием сильных оснований, таких как н-бутиллитий. Слабая С–Н-кислотность 1,3-дитиана связана со стабилизацией отрицательного заряда двумя атомами серы. Анион 1,3-дитиана может быть легко алкилирован действием алкилгалогенидов, причем повторное депротонирование, позволяет дважды алкилировать 1,3-дитиан (схема 7.33) [6]. Безусловным достоинством тиоацеталей в синтезе является возможность их трансформации в карбонильные соединения в исключительно мягких условиях катализа ионами ртути.
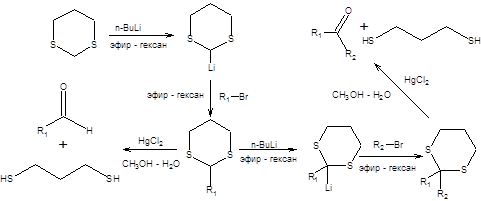
Схема 7.33
Последовательность стадий превращения альдегидов в производные 1,3-дитиана и их последующего депротонирования приводит к обращению заряда на атоме углерода, т.е. к обращению полярности карбонильной группы. Общая схема метода обращения полярности в терминах ретросинтетического анализа приведена ниже:
|
|
|
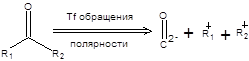
Схема 7.34
Метод обращения полярности с успехом применяется для синтеза α-кетоспиртов и β-кетоспиртов при взаимодействии анионов 1,3-дитиана с альдегидами или кетонами и эпоксидами соответственно, а также для синтеза спиртов при восстановлении продуктов конденсации никелем Ренея. Схемы синтеза α-кетоспиртов, β-кетоспиртов и спиртов исходя из 1,3-дитиана приведены ниже:

Схема 7.35
Реакции с участием 1,3-дитиана проводятся в мягких условиях, что позволяет применять их в синтезе полифункциональных субстратов.
Список литературы
1. D’Angelo J. // Tetrahedron. 1976. V. 32. P. 2979.
2. Смит В. А., Дильман А. Д. Основы современного органического синтеза. М. : Бином. Лаборатория знаний, 2009. С. 171 - 201.
3. Fleming I., Paterson I. // Sythesis. 1979. P. 736.
4. Schreiber S. L., Wang Z. // J. Am. Chem. Soc. 1985. V. 107. P. 5303.
5. Reetz M. T. et. al. // Chem. Ber. 1980.V. 113. P. 3741.
6. Corey E. J., Seebach D. // Angew. Chem. Int. Ed. Engl. 1965. V. 4. P. 1075.
Дата добавления: 2021-05-18; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
