Горение метана Горение метана
 CH 4 + 2 O 2 CO 2 + 2 H 2 O + Q
CH 4 + 2 O 2 CO 2 + 2 H 2 O + Q
Чтение уравнения:
(одна молекула метана вступает в реакцию с двумя молекулами кислорода с образованием одной молекулы углекислого газа и двух молекул воды).
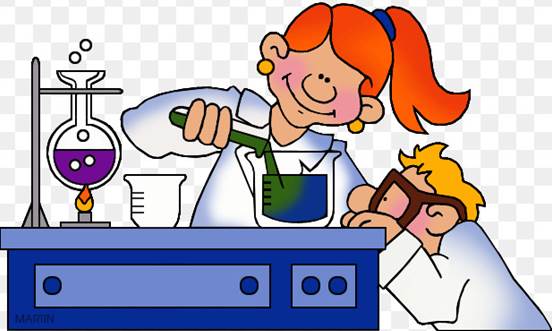
Газ горит голубым пламенем, при взаимодействии с воздухом в отношении 1 : 2 взрывается. Горит с образованием углекислого газа и воды – это горение полное. Экзотермическая реакция. Горение метана доказывает принадлежность его к органическим веществам(Рис.4.1,4.2).
2 свойство (замещение галогенами).
 1 этап CH4 + Cl2 CH3Cl + HCl
1 этап CH4 + Cl2 CH3Cl + HCl
хлорметан хлороводород
H H
| l
 H ― C ― H + Cl2 H ― C ― Cl + HCl
H ― C ― H + Cl2 H ― C ― Cl + HCl
| |
H H
 2 этап CH2 Cl + Cl2 CH2Cl2 + HCl
2 этап CH2 Cl + Cl2 CH2Cl2 + HCl
дихлорметан
H Cl
| |
 H ― C ― Cl + Cl2 H ― C ― Cl + HCl
H ― C ― Cl + Cl2 H ― C ― Cl + HCl
| |
H H

 3 этап CH2Cl2 + Cl2 CHCl3 + HCl
3 этап CH2Cl2 + Cl2 CHCl3 + HCl
|
|
|
трихлорметан
Cl Cl
| |
 H ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
H ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
| |
H H
 4 этап CHCl 3 + Cl 2 CCl4 + HCl
4 этап CHCl 3 + Cl 2 CCl4 + HCl
Тетрахлорметан
Cl Cl
| |
 Cl ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
Cl ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
| |
 H C
H C
Чтение уравнений реакции (например) 1 этап: одна молекула метана вступает в реакцию с одной молекулой хлора с образованием одной молекулы хлорметана и одной молекулы хлороводорода.
Вывод: для алканов характерны реакции замещения и отсутствие реакции с сильными кислотами, сильными основаниями, с сильными окислителями, например, не обесцвечивают раствор перманганата калия ( KMnO 4). Это объясняется прочностью сигма – связи
|
|
|
Тема 5:
Номенклатура
Как назвать предельные углеводороды с разветвлённым строением по международной номенклатуре?
Задание:
Назвать по международной номенклатуре соединение (Табл.2):
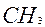
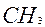
| |
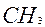 -
- 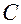 -
- 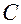 -
- 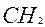 -
- 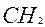 -
- 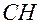 -
- 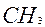
| | |
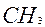
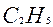
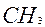
Таблица 2 Как назвать предельные углеводороды с разветвлённым строением по международной номенклатуре
| №№ пп | ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ВЫПОЛНЕНИЕ ДЕЙСТВИЙ |
| 1 | Выберете самую длинную углеродную «цепь», если имеются «свёрнутые» радикалы (боковые ответвления), то их следует развернуть . | 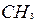 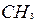 | |
| |
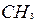 - - 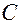 - - 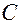 - - 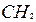 - - 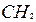 - - 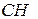 - - 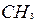 | | |
| | |
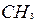 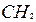 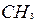 |
|
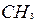
|
| 2 | Пронумеруйте атомы углерода начиная с того конца цепи: а) где ближе разветвление б) ближе к которому имеется больше ответвлений в) ближе к которому имеется более простой радикал | 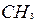 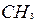 1 2 l 3 l 4 5 6 7
1 2 l 3 l 4 5 6 7
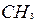 - - 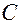 - - 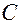 - - 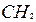 - - 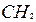 - - 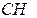 - - 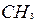 | | l
| | l
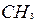 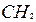 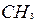 |
|
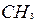
|
| 3 | Назовите радикалы (начиная с простейшего) и при помощи цифр укажите их место у пронумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала , тогда номер повторите дважды .Количество одинаковых радикалов укажите при помощи чисел на греческом языке( ди -два , три-три , тетра- четыре и т.д.) | 2,2 2,2,3,6 – тетраметил- 3 этил … |
| 4 | Полное название данному углеводороду дайте по числу атомов углерода в пронумерованной цепи. | 2,2,3,6 – тетраметил – 3 этилгептан |
|
|
|
НОМЕНКЛАТУРА
Как составить структурную формулу предельного углеводорода разветвлённого строения по его названию (Табл.3).
Задание: составить структурную формулу 2,6 – диметил – 3 этилгептана
|
|
|
Таблица3 Как составить структурную формулу предельного углеводорода разветвлённого строения по его названию
| №№ п/п | Последовательность действий | Выполнение действий |
| 1 | Определите число атомов углерода по корню слова означающего название | (ГЕПТ) – означает – (СЕМЬ) |
| 2 | Установите характер химической связи в молекуле по окончанию слова обозначающего название вещества | (АН)- Свидетельствует об ординарных связях в молекуле |
| 3 | Напишите углеводородную цепь | C – C – C – C – C – C – C |
| 4 | Пронумеруйте атомы углерода | 1 2 3 4 5 6 7 C – C – C – C – C – C – C |
| 5 | Напишите радикалы к соответствующим атомам углерода в цепи | 1 2 3 4 5 6 7
C – C – C – C – C – C – C
| | |
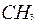 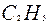 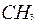
|
| 6 | Обеспечьте чёрточками недостающие валентности атома углерода |
| 1 | 2 | 3 | 4 | 5 | 6 | 7
– C – C – C – C – C – C – C –
| | | | | | |
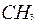 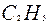 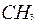
|
| 7 | Напишите у каждой (свободной) единицы валентности недостающие атомы водорода |
H H H H H H H
| | | | | | |
H – C – C – C – C – C – C – C – H
| | | | | | |
H 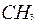 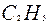 H H H H 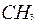 H H
|
| 8 | Замените полную структурную формулу сокращённой |
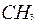 - - 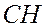 - - 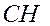 - - 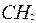 - - 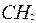 - - 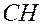 - - 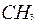 | | |
| | |
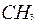 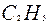 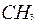
|
Тема 6:
Алгоритм решения задач
Найти молекулярную формулу углеводорода на основании данных количественного анализа и относительной плотности этого газа по другому газу.
При сгорании органического вещества получили оксид углерода (4) массой  и воду массой
и воду массой 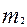 .
.
Плотность ρ равна Mr (в)


Рисунок6.1 Рисунок6.2
Mr ( ρ )
Определить молекулярную формулу веществ.
Дано:

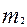 ρ
ρ
| Const Ar(c)=12 Mr( Ar(H)=1 Mr( Ar(O)= 12 Mr(Н 2) = 2 Mr (возд.) = 29 |
| Определить формулу вещества |
Найти:
1.Относительную молекулярную массу сгоревшего вещества:
а) Mr (в) = ρ · Mr ( ρ )
б) Mr (в) = ρ ( возд.) · Mr (возд.) = ρ (возд.) · 29
в) Mr (в) = ρ · Mr ( ρ ) = ρ (Н2) · Mr (Н2) = ρ (Н2) · 2
2.Массу углерода в оксиде углерода( IV ):
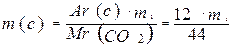
3.Массу водорода в образовавшейся воде:
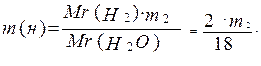
4.Число атомов углерода в молекуле простейшего вещества:

5.Число атомов водорода в молекуле простейшего вещества:

6.Относительную молекулярную массу простейшей формулы вещества:
Mr(CxHy) = x · Ar(c) + y · Ar(H) = x · 12 + y · 1
7.Во сколько раз Mr (в) > Mr ( CxHy )
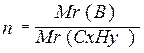
n (CxHy) Cn·x Hn·y
Основные источники:
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического
профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014.
Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественнонаучного профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014..
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред.проф. образования. М., 2014.
Журналы : «Химия и жизнь»
« Химия в школе»
« Наука и жизнь»
Дополнительные источники:
Габриелян О. С. и др. Химия для профессий и специальностей технического профиля
(электронное приложение).
ИНТЕРНЕТ-РЕСУРСЫ
Всероссийская олимпиада для школьников "Покори Воробьевы горы". https://pvg.mk.ru
Химия. Образовательный сайт для школьников. Экспериментальный учебник по химии для 8 и 11 классов средней школы. Общая и неорганическая химия. http://hemi.wallst.ru
Электронный учебник, информация о ЕГЭ ,тесты по химии ,примеры решения задач, история химии, занимательные опыты , биографии химиков, номенклатура, кинетика реакций, портреты химиков, химия в быту,витамины, химические таблицы, классификация реакции. http://allhimikov.ru
Информация о химических факультетах, вузах, ассоциациях. Электронная библиотека. Базы данных по химии. Сведения о конференциях, семинарах, конкурсах, олимпиадах. [ Электронный ресурс ] URL http://www.chem.msu.su (Дата обращения 17.05.2018)
Интернет-издание для учителей «Естественные науки».
Дата добавления: 2021-05-18; просмотров: 120; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

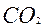 ) = 44
) = 44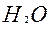 ) = 18
) = 18