Графическое строение атома углерода
1.3 Электронные облака.
Вращаясь в пространстве, электроны образуют облака.
S -электронам соответствуют облака шарообразной формы(Рис.1.6 А),
P -электронам соответствуют облака гантелеобразной формы(Рис.1.6 Б)
 Рисунок 1.6 А Рисунок 1.6 Б
Рисунок 1.6 А Рисунок 1.6 Б
S облако P облако
В атоме углерода на внешнем уровне имеется одно шарообразное S -облако и три гантелеобразных P -облака, располагающихся в разных плоскостях

Рисунок1.7
Виды электронных орбиталей
Химическая связь.
Ø Химическая связь- это общая область перекрывания электронных облаков. Чем больше область перекрывания электронных облаков ,тем химическая связь прочнее(Рис.1.8 А, Б).
 . Рисунок1.8 А Рисунок 1.8 Б
. Рисунок1.8 А Рисунок 1.8 Б
Сигма-связь П-связь
Тема 2:
Теория химического строения
Органических соединений
А.М.Бутлерова
Содержание:
Теория химического строения органических соединений.
Углеводороды и их классификация
Предельные углеводороды
|
|
|
Гомологический ряд алканов
Радикалы
2.1 Основой создания теории является два достижения химии:
|
а ) углерод 4-х валентен ― С ―
|
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Б) атомы углерода способны соединятся друг с другом ,образуя цепи .

 | | | | | | | |
| | | | | | | |
― C ― ― C ― ; ― С ― C ―; ― С ― С ― С ― С ―
| | | | | | | |
H H H H
| | | | полная
H ― C ― C ― C ― C ― H структурная
| | | | формула
 H H H H
H H H H
С H 3 – CH 2 – CH 2 – СН 3 CH 3 – CH – CH 3
|
|
|
|
CH 3
сокращенныеструктурныеформулы
C 4 H 10 молекулярнаяформула
Вещества, имеющие одинаковую молекулярную формулу, но разное химическое строение, а потому обладающие разными свойствами, называются изомерами.
2.2 Вещества, состоящие из двух элементов: углерода и водорода, называются углеводородами.
Классификация:
а) предельные (насыщенные)
б) непредельные
в) ароматические
2.3 Углеводороды, в молекулах которых все свободные валентности атомов углерода до предела насыщаются атомами водорода, называются предельными, насыщенными, парафинами, алканами.
2.4 Вещества, имеющие одинаковое строение и химические свойства, но отличающиеся друг от друга на группу –СН 2 - называются гомологами.
Таблица 1 Гомологический ряд алканов
| Название | Формула |
| Метан | CH 4 |
| Этан | C2 H 6 |
| Пропан | C3 H 8 |
| Бутан | C4 H 10 |
| Пентан | C5 H 12 |
| Гексан | C6 H 14 |
| Гептан | C7 H 16 |
| Октан | C8 H 18 |
| Нонан | C9 H 20 |
| Декан | C10 H 22 |
Общая формула алканов CnH2n+2
|
|
|
2.5 Частицы, образованные путем отнятия одного атома водорода от молекулы алкана, с заменой окончания АН на ИЛ называются радикалами.
Ø R -радикал
(R-)=(CnH2n+1)- общая формула радикалов
Примеры радикалов: CH 3- метил С2Н5- этил

Тема 3:
Строения молекулы метана
Строение молекулы метана
В молекулах метана все четыре химические связи оказались одинаковыми, это объясняется гибридизацией.
Ø ГИБРИДИЗАЦИЯ - это смешение и выравнивание разных по форме и энергии электронных облаков.
В молекулах метана смешиванию и выравниванию подвергается одно шарообразное S-облако и три гантелеобразных P-облака . Такой вид гибридизации называетсяSP³-гибридизация(Рис.3.1).
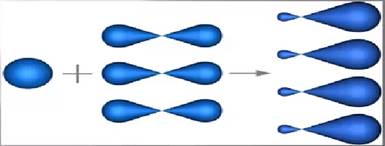
Рисунок3.1
SP³-гибридизация
В результате этого явления у атома углерода образуется четыре одинаковых по форме и энергии электронных облака , имеющих форму неправильной восьмерки. Такие облака получили название – ГИБРИДНЫЕ.
Каждое гибридное облако атома углерода перекрывается с шарообразным S-облаком атома водорода ,в месте их перекрывания возникает химическая связь, которая получила названия сигма- связи.
|
|
|
H
| -СИГМА - СВЯЗЬ
 H ― C ―H ВЫВОД: все 4 химические связи в молекуле
H ― C ―H ВЫВОД: все 4 химические связи в молекуле
Н метана одинаковы и прочны
Тема 4:
Химические свойства метана.
1 свойство (горение метана).


Рисунок4.1 Рисунок4.2
Дата добавления: 2021-05-18; просмотров: 144; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
