Й способ – через материальный баланс
Решение.
1. Масса 1л раствора равна: mр-ра= rр-ра. Vр-ра = 1,105×1000 = 1105г. По определению массовой доли, в 100г раствора содержится 10г Аl2(SО4)3, следовательно, в 1105г (т. е. в 1л) соответственно (1105×10)/100 = 110,5г. Молярная масса Аl2(SО4)3 MАl2(SО4)3 = 342г/моль. Таким образом, в 1л раствора содержится 110,5/342 = 0,32моль Аl2(SО4)3 и молярная концентрация раствора равна 0,32 моль/л.
2. Эквивалент молекулы Аl2(SО4)3 равен 1/6 молекулы: ЭАl2(SО4)3 = 1/6 Аl2(SО4)3. Соответственно, 1моль-эквивалент составляет 1/6 часть моля Аl2(SО4)3. Следовательно, в 1 моле Аl2(SО4)3 содержится 6 моль-эквивалентов, а в 1л данного раствора 0,32×6 = 1,92моль-экв Аl2(SО4)3. Молярная концентрация эквивалента равна 1,92моль/л.
3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5г растворенного вещества, то в 1мл находится 110,5/1000 = 0,1105г Аl2(SО4)3 и титр раствора Т = 0,1105 г/мл.
4. По условию, в 100г раствора содержится 10г Аl2(SО4)3 и 90г Н2О. Тогда на 1000г Н2О приходится (1000×10)/90 = 111,11г Аl2(SО4)3. Это составляет 111,11/342 = 0,325моля. Следовательно, в 1000г растворителя Н2О содержится 0,325моля растворенного вещества Аl2(SО4)3 и моляльность раствора равна 0,325моль/1000г Н2О.
5. Из данных п. 1 следует, что в 1л раствора содержится 1105–110,5 = 994,5г Н2О. Это составляет 994,5/18 = 55,25 молей. Откуда молярная доля Аl2(SО4)3 в растворе xАl2(SО4)3 = 0,32/(0,32 + 55,25) = 0,0058.
Пример 2. Рассчитайте рН 0,02 М раствора Н2SO4
Решение. Запишем уравнение диссоциации серной кислоты:
H2SO4 Þ 2H+ + SO4²ˉ .
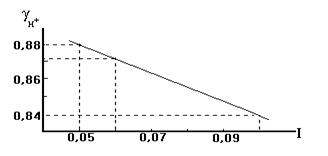
Cогласно уравнению при полном распаде на ионы концентрация ионов SO4²ˉ составит 0,02 моль/л, а концентрация ионов H+ - в 2 раза больше, то есть 0,04 моль/л. Для расчета рН следует определить активность ионов аН+ в данном растворе : аН+= g H+ СH+ . Коэффициент активности найдем по правилу ионной силы из табл. Ионная сила раствора : I = 1/2( 0,02·2²+ 0,04·1 ) = 0,06 В табл. имеются данные для g H+ при I=0,05 и I= 0,1 . Коэффициент активности для I= 0,06 найдем методом интерполяции, допуская линейную зависимость g от I в данном интервале ( см. график ). Итак, для I= 0,06, g = 0,872 . Искомое значение рН = - lg a H+ = - lg 0,872·0,04 = 1,46.
|
|
|
 |
Ответ : рН = 1,46.
Пример 3 . Рассчитайте рН 0,02М раствора Н2СО3
Решение: Запишем уравнение диссоциации слабого электролита:
Н2СО3 Û Н+ + НСО3‾; НСО3‾ Û Н+ + СО3²ˉ
1) Из табл. находим KД1 = 4,45 ∙10-7 ; KД2 = 4,8 ∙10-11 Поскольку KД1 больше KД2 на несколько порядков , то можно учитывать только ионы Н+ , образующиеся в результате 1-й ступени диссоциации . На основании закона Оствальда получаем :
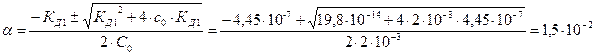 |
В данном случае можно рассчитать α и по упрощенному выражению:
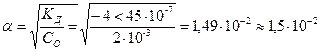 |
2) Концентрация ионов Н+ равна концентрации продиссоциировавших по 1-й ступени молекул Н2СО3.
|
|
|
Тогда по определению: α = CH +/ Co ;
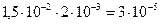 CH + = αCo =
CH + = αCo =
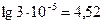 3) Искомое значение рН = - lg Cн+ =
3) Искомое значение рН = - lg Cн+ =
Ответ : рН = 4,52 .
Пример 4. Рассчитайте константу гидролиза сульфит-иона по 1-й и 2-й ступени и сделайте вывод о возможности протекания гидролиза по 2-й ступени при комнатных температурах.
Решение: Запишем уравнения гидролиза иона SO3ˉ2 по двум ступеням и выражения для соответствующих констант гидролиза:
SO3²ˉ + H2 O Û HSO3 ‾+ OHˉ,
KГ1 = C Н SO 3ˉ · COH ˉ / C SO 3 ˉ2 = KВ / K Д HSO 3 ˉ
HSO3‾ + H2O Û H2SO3 + OHˉ
KГ 2 = C H2SO3 ·C OH‾ / C HSO3‾ = KВ / K Д H2SO3
Уравнение диссоциации слабой сернистой кислоты:
H2 SO3 Û Н+ + HSO3‾ ( 1 ступень ) KД1 = 1,7·10-2
HSO3‾ Û Н+ + SO3²ˉ (2 ступень) КД2 = 6, 3·10-8
Из приведенных уравнений диссоциации видно, что для расчета КГ по 1-й ступени следует взять константу диссоциации слабого электролита по 2-й ступени и наоборот:
KГ1 = 10-14 /6, 3·10-8= 1,57·10-7
K Г2 = 10-14 /1, 7·10-2= 5,9·10-13
KГ1 >> KГ2
Ответ: KГ1 =1,57·10-7 KГ2 = 5,9·10-13
Малая величина КГ2 свидетельствует о том, что гидролиз сульфит-иона по 2-й ступени практически не идет
|
|
|
Задача 5. Рассчитать КГ, b и рН раствора К2 S О3 ( С = 0,01моль/л) при 250С.
Решение Диссоциация сильного электролита К2 S О3:
со 2со со
К2SО3 → 2К+ + SО32-
 |  | ||
КОН Н2 S О3
Сильное слабая кислота
Основание
Гидролиз по S О32 - :
1-ая ступень: S О32 - + НОН Û Н S О3 - + ОН -
КГ1 = 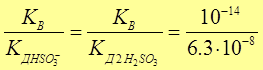 = 1,59 × 10 - 7
= 1,59 × 10 - 7
2-ая ступень: Н S О3 - + Н2О Û Н2 S О3 + ОН -
КГ2 = 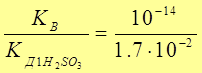 = 5,9 × 10 - 13 . К Г1 > > К Г2 ,поэтомудальнейший расчет для 1-ой ступени гидролиза.
= 5,9 × 10 - 13 . К Г1 > > К Г2 ,поэтомудальнейший расчет для 1-ой ступени гидролиза.
й способ – через материальный баланс
| SO32- | НSO3- | OН- | |
| cисход | со | 0 | 0 |
| Dc | x | x | x |
| cравн | со - x | x | x |
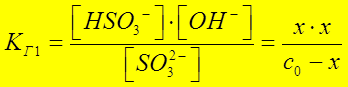 Þ x = [ ОН - ] Þ pOH Þ pH
Þ x = [ ОН - ] Þ pOH Þ pH
x = [ОН-] = 4 × 10 - 5 ; pOH = - lg [ОН-] = 4,4 ; pH = 14 -4,4 = 9,6
(Обратная задача: Зная рН раствора, рассчитать его концентрацию c 0 .
Алгоритм решения: pH Þ pOH ; x = 10-рОН Þ со )
Дата добавления: 2021-05-18; просмотров: 41; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
