Молекулярные основы патогенеза
Содержание
Прионы
История <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Свойства молекул <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Молекулярные основы патогенеза <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Классификация <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Этиология <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Пути заражения <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Прионы и медицинские инструменты <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Прионные заболевания человека <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Потенциальная опасность для человека <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Исследования прионов дрожжей и других микромицетов <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Критика <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Литература <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%BE%D0%BD>
Прионы
Прио́ны (от англ. <http://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%BB%D0%B8%D0%B9%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> proteinaceous infectious particles - белковые заразные частицы) - особый класс инфекционных <http://ru.wikipedia.org/wiki/%D0%98%D0%BD%D1%84%D0%B5%D0%BA%D1%86%D0%B8%D1%8F> агентов <http://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5_%D0%B8%D0%BD%D1%84%D0%BE%D1%80%D0%BC%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5_%D0%B0%D0%B3%D0%B5%D0%BD%D1%82%D1%8B>, чисто белковых <http://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BA%D0%B8>, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания <http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%B1%D0%BE%D0%BB%D0%B5%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> центральной нервной системы у человека <http://ru.wikipedia.org/wiki/%D0%A7%D0%B5%D0%BB%D0%BE%D0%B2%D0%B5%D0%BA> и ряда высших животных <http://ru.wikipedia.org/wiki/%D0%96%D0%B8%D0%B2%D0%BE%D1%82%D0%BD%D0%BE%D0%B5> (так называемые «медленные инфекции»).
|
|
|
Прионный белок <http://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BE%D0%BA>, обладающий аномальной трёхмерной структурой, способен прямо катализировать <http://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%82%D0%B0%D0%BB%D0%B8%D0%B7> структурное превращение гомологичного <http://ru.wikipedia.org/wiki/%D0%93%D0%BE%D0%BC%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F_%28%D0%B1%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F%29> ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%84%D0%BE%D1%80%D0%BC%D0%B0%D1%86%D0%B8%D1%8F_%28%D1%85%D0%B8%D0%BC%D0%B8%D1%8F%29>. Как правило, прионное состояние белка характеризуется переходом б-спиралей <http://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D1%84%D0%B0-%D1%81%D0%BF%D0%B8%D1%80%D0%B0%D0%BB%D0%B8> белка в в-слои <http://ru.wikipedia.org/w/index.php?title=%D0%91%D0%B5%D1%82%D0%B0-%D1%81%D0%BB%D0%BE%D0%B8&action=edit&redlink=1>.
История
Во второй половине XX века <http://ru.wikipedia.org/wiki/XX_%D0%B2%D0%B5%D0%BA> врачи столкнулись с необычным заболеванием человека - постепенно прогрессирующим разрушением головного мозга <http://ru.wikipedia.org/wiki/%D0%93%D0%BE%D0%BB%D0%BE%D0%B2%D0%BD%D0%BE%D0%B9_%D0%BC%D0%BE%D0%B7%D0%B3>, происходящим в результате гибели нервных клеток <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%B9%D1%80%D0%BE%D0%BD%D1%8B>. Это заболевание получило название губчатой энцефалопатии <http://ru.wikipedia.org/w/index.php?title=%D0%A1%D0%BF%D0%BE%D0%BD%D0%B3%D0%B8%D0%BB%D0%BE%D1%84%D0%BE%D1%80%D0%BC%D0%BD%D0%B0%D1%8F_%D1%8D%D0%BD%D1%86%D0%B5%D1%84%D0%B0%D0%BB%D0%BE%D0%BF%D0%B0%D1%82%D0%B8%D1%8F&action=edit&redlink=1>. Похожие симптомы были известны давно, но наблюдались они не у человека, а у животных (скрейпи <http://ru.wikipedia.org/wiki/%D0%A1%D0%BA%D1%80%D0%B5%D0%B9%D0%BF%D0%B8> овец), и долгое время между ними не находили достаточной обоснованной связи.
|
|
|
Открытие прионов тесно связано с историей открытия и становления учения о медленных инфекциях, когда в 1954 г. Б. Сигурдссон (Швеция) изложил результаты своих многолетних исследований массовых заболеваний среди овец, завезенных в 1933 г. из Германии на о. Исландия для развития каракулеводства. Несмотря на явные клинические различия и неодинаковую локализацию повреждений органов и тканей, шведский ученый сумел обнаружить среди изученных им заболеваний принципиальное сходство, которое в современном виде может быть суммировано в виде четырех главных признаков, отличающих медленные инфекции:
необычно продолжительный (месяцы и годы) инкубационный период;
медленно прогрессирующий характер течения;
необычность поражения органов и тканей;
неизбежность смертельного исхода.
Среди заболеваний овец была подробно исследована давно и хорошо знакомая во многих странах болезнь этих животных, известная под названием «скрэпи», полностью отвечавшая всем четырем характеристикам медленных инфекций.
|
|
|
Три года спустя на о. Новая Гвинея обнаружили и описали новое заболевание среди папуасов-каннибалов, которое известно сегодня под названием «куру». Болезнь носила массовый характер и успешной передачей сначала шимпанзе, а позднее и низшим обезьянам была доказана ее инфекционная природа. Очень скоро было выявлено большое сходство между эпидемиологий, клиническими проявлениями и патоморфологической картиной при куру у человека и при скрэпи у овец, на основании чего стало очевидным, что медленные инфекции могут поражать не только животных, но и людей.
Новый интерес к их изучению возник в 1996 <http://ru.wikipedia.org/wiki/1996> году, когда в Великобритании появилась новая форма заболевания, обозначаемая как «новый вариант болезни Крейтцфельдта-Якоба <http://ru.wikipedia.org/wiki/%D0%91%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8C_%D0%9A%D1%80%D0%B5%D0%B9%D1%82%D1%86%D1%84%D0%B5%D0%BB%D1%8C%D0%B4%D1%82%D0%B0_%E2%80%94_%D0%AF%D0%BA%D0%BE%D0%B1%D0%B0> (nvCJD)».
Важным событием было распространение «коровьего бешенства <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D0%B2%D1%8C%D0%B5_%D0%B1%D0%B5%D1%88%D0%B5%D0%BD%D1%81%D1%82%D0%B2%D0%BE>» в Великобритании, эпидемия которого была сначала в 1992-1993 годов, а потом и в 2001 году охватила несколько европейских государств, но тем не менее экспорт мяса во многие страны не был прекращён. Заболевание связывают с использованием «прионизированной» костной муки <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%81%D1%82%D0%BD%D0%B0%D1%8F_%D0%BC%D1%83%D0%BA%D0%B0> в кормах <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BC> и премиксах <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B5%D0%BC%D0%B8%D0%BA%D1%81>, изготовленной из туш павших или заболевших животных, возможно, и не имевших явных признаков заболевания.
|
|
|
Пути переноса причинного фактора болезни, механизмы проникновения прионов в организм и патогенез заболевания изучены пока недостаточно.
В 1997 г. американскому врачу Стенли Прузинеру <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D1%83%D0%B7%D0%B8%D0%BD%D0%B5%D1%80,_%D0%A1%D1%82%D0%B5%D0%BD%D0%BB%D0%B8> была присуждена Нобелевская премия <http://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D0%B1%D0%B5%D0%BB%D0%B5%D0%B2%D1%81%D0%BA%D0%B0%D1%8F_%D0%BF%D1%80%D0%B5%D0%BC%D0%B8%D1%8F> за изучение прионов.
Свойства молекул
Прионовые белки млекопитающих не сходны с прионовыми белками дрожжей по аминокислотной последовательности. Несмотря на это, основные структурные особенности (формирование амилоидных <http://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%BB%D0%BE%D0%B8%D0%B4> волокон и высокая специфичность, препятствующая передаче прионов от одного вида организмов к другому) у них общие. Вместе с тем, прион, отвечающий за коровье бешенство <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D0%B2%D1%8C%D0%B5_%D0%B1%D0%B5%D1%88%D0%B5%D0%BD%D1%81%D1%82%D0%B2%D0%BE>, обладает способностью передаваться от вида к виду.
Молекулярные основы патогенеза
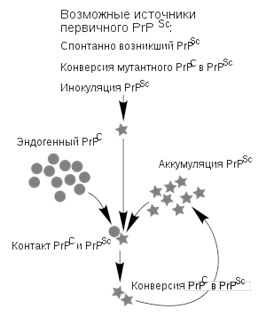
Предполагаемый механизм «размножения» прионов.
В ходе исследований мозговых тканей умерших от прионных инфекций животных было показано, что прионы не содержат нуклеиновых кислот, а представляют собой белки. Одним из первых охарактеризованных прионных белков стал PrP (от англ. prion-related protein или protease-resistant protein) массой около 35 <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%B2%D0%BA%D0%B8_%D0%A1%D0%98>Да <http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F_%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%BC%D0%B0%D1%81%D1%81%D1%8B>. Известно, что PrP может существовать в двух конформациях <http://ru.wikipedia.org/w/index.php?title=%D0%9A%D0%BE%D0%BD%D1%84%D0%BE%D1%80%D0%BC%D0%B0%D1%86%D0%B8%D1%8F_%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0&action=edit&redlink=1> - «здоровой» - PrPC, которую он имеет в нормальных клетках (C - от англ <http://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%BB%D0%B8%D0%B9%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>ийского cellular - «клеточный»), в которой преобладают альфа-спирали <http://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D1%84%D0%B0-%D1%81%D0%BF%D0%B8%D1%80%D0%B0%D0%BB%D1%8C>, и «патологической» - PrPSc, собственно прионной (Sc- от scrapie), для которой характерно наличие большого количества бета-тяжей <http://ru.wikipedia.org/w/index.php?title=%D0%91%D0%B5%D1%82%D0%B0-%D1%82%D1%8F%D0%B6&action=edit&redlink=1>. При попадании в здоровую клетку, PrPSc катализирует переход клеточного PrPC в прионную конформацию. Накопление прионного белка сопровождается его агрегацией, образованием высокоупорядоченных фибрил (амилоидов <http://ru.wikipedia.org/w/index.php?title=%D0%90%D0%BC%D0%B8%D0%BB%D0%BE%D0%B8%D0%B4%D1%8B&action=edit&redlink=1>), что в конце концов приводит к гибели клетки. Высвободившийся прион, по-видимому, оказывается способен проникать в соседние клетки, также вызывая их гибель.
Функции белка PrPC в здоровой клетке - поддержание качества миелиновой <http://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%B5%D0%BB%D0%B8%D0%BD> оболочки, которая в отсутствии этого белка постепенно истончается. В норме белок PrPC ассоциирован с клеточной мембраной, гликозилирован остатком сиаловой кислоты. Он может совершать циклические переходы внутрь клетки и обратно на поверхность в ходе эндо <http://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B4%D0%BE%D1%86%D0%B8%D1%82%D0%BE%D0%B7>- и экзоцитоза <http://ru.wikipedia.org/wiki/%D0%AD%D0%BA%D0%B7%D0%BE%D1%86%D0%B8%D1%82%D0%BE%D0%B7>. Один такой цикл длится около часа. В эндоцитозном пузырьке или на поверхности клетки молекула PrPC может разрезаться протеазами <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%82%D0%B5%D0%B0%D0%B7%D0%B0> на две примерно равные части.
До конца механизм спонтанного возникновения прионных инфекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе <http://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BE%D1%81%D0%B8%D0%BD%D1%82%D0%B5%D0%B7> белков. Мутации <http://ru.wikipedia.org/wiki/%D0%9C%D1%83%D1%82%D0%B0%D1%86%D0%B8%D1%8F> генов <http://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BD>, кодирующих прионный белок (PrP), ошибки трансляции <http://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B0%D0%BD%D1%81%D0%BB%D1%8F%D1%86%D0%B8%D1%8F_%28%D0%B1%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F%29>, процессы протеолиза <http://ru.wikipedia.org/w/index.php?title=%D0%9F%D1%80%D0%BE%D1%82%D0%B5%D0%BE%D0%BB%D0%B8%D0%B7&action=edit&redlink=1> - считаются главными кандидатами на механизм возникновения прионов. Согласно недавно проведённым исследованиям прионы способны к дарвиновской эволюции за счёт действия естественного отбора.
Есть данные, дающее основание считать, что прионы являются не только инфекционными агентами, но и имеют функции в нормальных биопроцессах. Так, например, существует гипотеза, что через прионы осуществляется механизм генетически обусловленного стохастического старения.
Классификация
| Прионы млекопитающих <http://ru.wikipedia.org/wiki/%D0%9C%D0%BB%D0%B5%D0%BA%D0%BE%D0%BF%D0%B8%D1%82%D0%B0%D1%8E%D1%89%D0%B8%D0%B5> - возбудители губчатой энцефалопатии | ||||
| ICTVdb <http://www.ncbi.nlm.nih.gov/ICTVdb/> CodeЗаболеваниеНосительНазвание прионаPrP изоформа <http://ru.wikipedia.org/w/index.php?title=%D0%98%D0%B7%D0%BE%D1%84%D0%BE%D1%80%D0%BC%D0%B0&action=edit&redlink=1> | ||||
| 90.001.0.01.001. <http://www.ncbi.nlm.nih.gov/ICTVdb/ICTVdB/90.001.0.01.001.htm>Скрейпи <http://ru.wikipedia.org/wiki/%D0%A1%D0%BA%D1%80%D0%B5%D0%B9%D0%BF%D0%B8>Овцы <http://ru.wikipedia.org/wiki/%D0%9E%D0%B2%D1%86%D1%8B> и козы <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%B7%D1%8B>Прион скрейпиOvPrPSc | ||||
| 90.001.0.01.002. | Трансмиссивная энцефаломиопатия норок <http://ru.wikipedia.org/w/index.php?title=%D0%A2%D1%80%D0%B0%D0%BD%D1%81%D0%BC%D0%B8%D1%81%D1%81%D0%B8%D0%B2%D0%BD%D0%B0%D1%8F_%D1%8D%D0%BD%D1%86%D0%B5%D1%84%D0%B0%D0%BB%D0%BE%D0%BC%D0%B8%D0%BE%D0%BF%D0%B0%D1%82%D0%B8%D1%8F_%D0%BD%D0%BE%D1%80%D0%BE%D0%BA&action=edit&redlink=1> (ТЭН)Норки <http://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D1%80%D0%BA%D0%B8>Прион ТЭНMkPrPSc | |||
| 90.001.0.01.003. | Chronic wasting disease <http://ru.wikipedia.org/w/index.php?title=Chronic_wasting_disease&action=edit&redlink=1> (CWD)Олени <http://ru.wikipedia.org/wiki/%D0%9E%D0%BB%D0%B5%D0%BD%D0%B8> и лоси <http://ru.wikipedia.org/wiki/%D0%9B%D0%BE%D1%81%D0%B8>CWD прионMDePrPSc | |||
| 90.001.0.01.004. | Губчатая энцефалопатия крупного рогатого скота <http://ru.wikipedia.org/wiki/%D0%93%D1%83%D0%B1%D1%87%D0%B0%D1%82%D0%B0%D1%8F_%D1%8D%D0%BD%D1%86%D0%B5%D1%84%D0%B0%D0%BB%D0%BE%D0%BF%D0%B0%D1%82%D0%B8%D1%8F_%D0%BA%D1%80%D1%83%D0%BF%D0%BD%D0%BE%D0%B3%D0%BE_%D1%80%D0%BE%D0%B3%D0%B0%D1%82%D0%BE%D0%B3%D0%BE_%D1%81%D0%BA%D0%BE%D1%82%D0%B0> (ГЭКРС)Коровы <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D0%B2%D1%8B>Прион ГЭКРСBovPrPSc | |||
| 90.001.0.01.005. | Губчатая энцефалопатия кошачьих <http://ru.wikipedia.org/w/index.php?title=%D0%93%D1%83%D0%B1%D1%87%D0%B0%D1%82%D0%B0%D1%8F_%D1%8D%D0%BD%D1%86%D0%B5%D1%84%D0%B0%D0%BB%D0%BE%D0%BF%D0%B0%D1%82%D0%B8%D1%8F_%D0%BA%D0%BE%D1%88%D0%B0%D1%87%D1%8C%D0%B8%D1%85&action=edit&redlink=1> (ГЭК)Кошки <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%88%D0%BA%D0%B8>Прион ГЭКFePrPSc | |||
| 90.001.0.01.006. | Губчатая энцефалопатия экзотических копытных (EUE) | Антилопы и большой куду | EUE прион | NyaPrPSc |
| 90.001.0.01.007. | Куру <http://ru.wikipedia.org/wiki/%D0%9A%D1%83%D1%80%D1%83_%28%D0%B1%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8C%29>Люди <http://ru.wikipedia.org/wiki/%D0%9B%D1%8E%D0%B4%D0%B8>Прион куруHuPrPSc | |||
| 90.001.0.01.008. | Болезнь Крейцфельда-Якоба <http://ru.wikipedia.org/wiki/%D0%91%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8C_%D0%9A%D1%80%D0%B5%D0%B9%D1%86%D1%84%D0%B5%D0%BB%D1%8C%D0%B4%D0%B0-%D0%AF%D0%BA%D0%BE%D0%B1%D0%B0> (БКЯ)ЛюдиПрион БКЯHuPrPSc | |||
| (New) Variant Creutzfeldt-Jakob disease (vCJD, nvCJD) | Люди | vCJD прион | HuPrPSc | |
| 90.001.0.01.009. | --Ñèíäðîì ÃåðñòìàííàØòðîéñëåðàØåéíêåðà <http://ru.wikipedia.org/wiki/Gerstmann-Str%C3%A4ussler-Scheinker_syndrome> (GSS)ЛюдиGSS прионHuPrPSc | |||
| 90.001.0.01.010. | Хроническая семейная бессонница <http://ru.wikipedia.org/wiki/%D0%A5%D1%80%D0%BE%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B5%D0%BC%D0%B5%D0%B9%D0%BD%D0%B0%D1%8F_%D0%B1%D0%B5%D1%81%D1%81%D0%BE%D0%BD%D0%BD%D0%B8%D1%86%D0%B0> (ХСБ)ЛюдиПрион ХСБHuPrPSc | |||
Этиология
Человек может заразиться прионами, содержащимися в пище, так как они не разрушаются ферментами пищеварительного тракта. Беспрепятственно проникая через стенку тонкого кишечника, они в конечном итоге попадают в центральную нервную систему. Так переносится новый вариант болезни Крейтцфельдта-Якоба (nvCJD), которой люди заражаются после употребления в пищу говядины, содержащей нервную ткань из голов скота, больных бычьей губчатой энцефалопатией (BSE, коровье бешенство <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D0%B2%D1%8C%D0%B5_%D0%B1%D0%B5%D1%88%D0%B5%D0%BD%D1%81%D1%82%D0%B2%D0%BE>).
Прионы могут проникать в тело и парентеральным путем. Были описаны случаи заражения при внутримышечном введении препаратов, изготовленных из человеческих гипофизов <http://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%BF%D0%BE%D1%84%D0%B8%D0%B7> (главным образом гормоны роста <http://ru.wikipedia.org/w/index.php?title=%D0%93%D0%BE%D1%80%D0%BC%D0%BE%D0%BD%D1%8B_%D1%80%D0%BE%D1%81%D1%82%D0%B0&action=edit&redlink=1> для лечения карликовости <http://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%BB%D0%B8%D0%BA%D0%BE%D0%B2%D0%BE%D1%81%D1%82%D1%8C>), а также заражение мозга инструментами при нейрохирургических операциях, поскольку прионы устойчивы к применяемым в настоящее время термическим и химическим методам стерилизации <http://ru.wikipedia.org/wiki/%D0%A1%D1%82%D0%B5%D1%80%D0%B8%D0%BB%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D1%8F>. Эта форма болезни Крейтцфельдта-Якоба обозначается как ятрогенная (1CJD).
При определённых, неизвестных условиях, в организме человека может произойти спонтанная трансформация прионного белка в прион. Так возникает так называемая спорадическая болезнь Крейтцфельдта-Якоба (sCJD), впервые описанная в 1920 г. независимо друг от друга Гансом Герхардом Крейтцфельдтом и Альфонсом Марией Якобом. Предполагается, что спонтанное возникновение этой болезни связано с фактом, что в норме в человеческом теле постоянно возникает небольшое количество прионов, которые эффективно ликвидируются клеточным Аппаратом Гольджи <http://ru.wikipedia.org/wiki/%D0%90%D0%BF%D0%BF%D0%B0%D1%80%D0%B0%D1%82_%D0%93%D0%BE%D0%BB%D1%8C%D0%B4%D0%B6%D0%B8>. Нарушение этой способности «самоочищения» клеток может привести к повышению уровня прионов выше допустимой границы нормы и к их дальнейшему неконтролируемому распространению. Причиной возникновения спорадической болезни Крейтцфельдта-Якоба согласно этой теории является нарушение функции Аппарата Гольджи в клетках.
Особую группу прионовых заболеваний представляют собой наследственные (врожденные) болезни, вызванные мутацией <http://ru.wikipedia.org/wiki/%D0%9C%D1%83%D1%82%D0%B0%D1%86%D0%B8%D1%8F> гена прионового белка, который делает возникший прионовый белок более подверженным спонтанному изменению пространственной конфигурации и превращения их в прионы. К этой группе наследственных заболеваний относится и наследственная форма болезни Крейтцфельдта-Якоба (fCJD), которая наблюдается в ряде стран мира.
При прионовой патологии наивысшая концентрация прионов обнаружена в нервной ткани заражённых людей. Значительное количество прионов встречается в лимфатической ткани <http://ru.wikipedia.org/w/index.php?title=%D0%9B%D0%B8%D0%BC%D1%84%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%82%D0%BA%D0%B0%D0%BD%D1%8C&action=edit&redlink=1>. Наличие прионов в биологических жидкостях, включая слюну, пока не было однозначно подтверждено. Если представление о постоянном возникновении небольшого количества прионов верно, то можно предположить, что новые, более чувствительные методы диагностики откроют это количество прионов, разбросанное по различным тканям. В данном случае, однако, речь пойдёт о «физиологическом» уровне прионов, которые не представляют собой никакой угрозы для человека.
Пути заражения
Очень мало известно о молекулярном характере прионов, вызывающих заболевания. Заражение могут вызвать примерно 100 000 молекул, которые в большинстве случаев образуют большие скопления. Значение агрегации <http://ru.wikipedia.org/wiki/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%86%D0%B8%D1%8F> отдельных молекул в ассоциации для вирулентности <http://ru.wikipedia.org/wiki/%D0%92%D0%B8%D1%80%D1%83%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C> прионов - устойчивость к действию ферментов <http://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D1%80%D0%BC%D0%B5%D0%BD%D1%82%D1%8B>, расщепляющих белки, ставшие ненужными. Нельзя исключить, что вирулентными являются и отдельные молекулы прионов. Из некоторых экспериментов следует, что для возникновения прионов в ткани достаточно лишь временного контакта ткани с материалом, содержащим прионы, и нет необходимости, чтобы прионы были навсегда внесены в организм. Этот риск является актуальным, например, в связи с использованием хирургических инструментов, заражённых прионами. Процесс трансформации «здоровых» прионовых белков в прионы может быть инициирован простым контактом здоровых тканей с прионами, зафиксированными на хирургическом инструменте.
Ход болезни и распространение прионов по организму зависит от типа приона. Прионы отличаются составом аминокислот, характерных для данного вида, определяемых видовым геном прионового белка, а также так называемыми посттрансляционными модификациями <http://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D1%81%D1%82%D1%82%D1%80%D0%B0%D0%BD%D1%81%D0%BB%D1%8F%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BC%D0%BE%D0%B4%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D1%8F> или степенью гликозилирования <http://ru.wikipedia.org/wiki/%D0%93%D0%BB%D0%B8%D0%BA%D0%BE%D0%B7%D0%B8%D0%BB%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> базовой белковой цепочки. Посттрансляционная модификация <http://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D1%81%D1%82%D1%82%D1%80%D0%B0%D0%BD%D1%81%D0%BB%D1%8F%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BC%D0%BE%D0%B4%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D1%8F> значительно влияет на характеристики прионов и именно ей приписывают разницу между так называемыми прионовыми родами. В случае нового варианта (nvCJD) был пока что описан лишь один вид приона, сходный с прионами скота, заражённого бычьей губчатой энцефалопатией. Поэтому течение заболевания у человека и животных, заражённых новым вариантам, практически одинаково. У прочих видов живых существ, однако, известно много прионовых родов. У овец были описаны примерно два десятка таких родов, которые не вирулентны для человека. Течение овечьего прионового заболевания в зависимости от рода прионов значительно отличается - от очень быстрого, с практически внезапной гибелью, до медленного, затяжного.
Нетипичные случаи клинического течения нового варианта у скота, заражённого бычьей губчатой энцефалопатией, которые имели место в Японии и Италии, наводят на мысль о существовании большего количества родов бычьих прионов. Если бы этот род бычьих прионов попал в организм человека, следовало бы ожидать возникновение нового варианта с симптомами и клиническим течением, отличными от известных случаев.
У пациентов, больных болезнью Крейтцфельдта-Якоба, прионы распространяются в нервной системе, тканях глаза <http://ru.wikipedia.org/wiki/%D0%93%D0%BB%D0%B0%D0%B7> и лимфатических тканям, включая миндалины <http://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B4%D0%B0%D0%BB%D0%B8%D0%BD%D0%B0>, селезенку <http://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D0%BB%D0%B5%D0%B7%D0%B5%D0%BD%D0%BA%D0%B0>, а также в слепой кишке <http://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D0%B5%D0%BF%D0%B0%D1%8F_%D0%BA%D0%B8%D1%88%D0%BA%D0%B0>. Наибольшее количество прионов находится в нервной системе, а наименьшее - в лимфатической ткани.
Пока что не был зарегистрирован ни один случай переноса нового варианта болезни Крейтцфельдта-Якоба (nvCJD) при медицинском вмешательстве, что является, разумеется, хорошей новостью. С другой стороны, специалисты предупреждают о преувеличенном оптимизме, прежде всего в условиях Великобритании, так как инкубационный период <http://ru.wikipedia.org/wiki/%D0%98%D0%BD%D0%BA%D1%83%D0%B1%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4> может быть достаточно долгим (от 5-8 месяцев до 10-15 лет).
Дата добавления: 2021-04-24; просмотров: 39; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
