Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
б) температура;
В) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
|
|
|
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо: 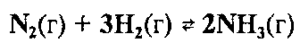
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азоти водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
|
|
|
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 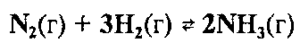 , так как при протекании прямой реакции число газообразных молекул уменьшается (из четырех молекул газов азота и водорода образуются две молекулы газа аммиака).
, так как при протекании прямой реакции число газообразных молекул уменьшается (из четырех молекул газов азота и водорода образуются две молекулы газа аммиака).
Дата добавления: 2021-04-24; просмотров: 94; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
