Химическое равновесие и способы его смещения
Тема. Обратимость химических реакций.
Все химические реакции делятся на два типа: обратимые и необратимые.
Необратимыми называются реакции, которые протекают только в одном направлении, т. е. продукты этих реакций не взаимодействуют друг с другом с образованием исходных веществ.
Необратимая реакция заканчивается тогда, когда полностью расходуется хотя бы одно из исходных веществ. Необратимыми являются реакции горения; многие реакции термического разложения сложных веществ; большинство реакций, в результате которых образуются осадки или выделяются газообразные вещества, и др. Например:
C2H5OH + 3O2 → 2CO2 + 3H2O
2KMnO4 = K2MnO4 + MnO2 + O2↑
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Большинство реакций являются обратимыми.
Обратимые реакции – это такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В промышленности обратимые реакции не выгодны, поэтому прибегают к различным факторам необратимости реакций:
1. Выпадает осадок или выделяется газ.
2. Хлорид бария и серная кислота, карбонат натрия и соляная кислота.
3. Образуется малодиссоциирующее вещество, например вода.
4. Соляная кислота и гидроксид натрия.
5. Реакция сопровождается выделением большого количества энергии.
|
|
|
6. Магний и кислород.
Обратимыми называются реакции, которые одновременно протекают в прямом и в обратом направлениях:

В уравнениях обратимых реакций используется знак обратимости 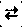 .
.
Примером обратимой реакции является синтез йодоводорода изводорода и йода: 
Через некоторое время после начала химической реакции в газовой смеси можно обнаружить не только конечный продукт реакции НI, но и исходные вещества —H2 и I2. Как бы долго ни продолжалась реакция, в реакционной смеси при 350oС всегда будет содержаться приблизительно 80% HI,10% Н2 и 10% I2. Если в качестве исходного вещества взять НI и нагреть его до той же температуры, то можно обнаружить, что через некоторое время соотношение между количествами всех трех веществ будет таким же. Таким образом, при образовании йодоводорода из водорода и йода одновременно осуществляются прямая и обратная реакции.
Если в качестве исходных веществ взяты водород и йод в концентрациях [H2] и [I2], то скорость прямой реакции в начальный момент времени была равна: vпр = kпр[H2] ∙ [I2]. Скорость обратной реакции vобр = kобр[HI]2 в начальный момент времени равна нулю, так как йодоводород в реакционной смеси отсутствует ([HI] = 0). Постепенно скорость прямой реакции уменьшается, так как водород и йод вступают в реакцию и их концентрации понижаются. При этом скорость обратной реакции увеличивается, потому что концентрация образующегося йодоводорода постепенно возрастает. Когда скорости прямой и обратной реакций станут одинаковыми, наступает химическое равновесие. В состоянии равновесия за определенный промежуток времени образуется столько же молекул НI, сколько их распадается на Н2 и I2
|
|
|
Химическое равновесие и способы его смещения
Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют:
Концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое либо внешнее воздействие, тов системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
|
|
|
Дата добавления: 2021-04-24; просмотров: 137; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
