Влияние температуры на скорость химических реакций.
Энергия активации химической реакции
Для большинства химических превращений за исключением реакций третьего порядка и ферментативных процессов скорость реакции возрастает с повышением температуры. Для гетерогенных реакций температурный коэффициент скорости обычно ниже, чем для гомогенных, так как при этом накладывается влияние других факторов, и наиболее медленной стадией процесса является не сама химическая реакция, а процессы диффузии, адсорбции и т.п. Зависимость скорости гомогенной реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при нагревании на каждые 100 константа скорости увеличивается в два – четыре раза, т.е.
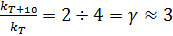 , (37)
, (37)
где kT+10 – константа скорости при температуре t+100; kT – константа скорости той же реакции при температуре t0.
Отношение 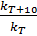 называется температурным коэффициентом и обозначается γ. Определив γ, можно приближенно рассчитать константу скорости при любой температуре по уравнению:
называется температурным коэффициентом и обозначается γ. Определив γ, можно приближенно рассчитать константу скорости при любой температуре по уравнению:
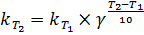 (38)
(38)
в небольшом интервале температур. Правило Вант-Гоффа применяется для ориентировочных расчетов. Более точно зависимость скорости реакции от температуры описывается уравнением Аррениуса:
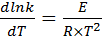 (39)
(39)
где k – константа скорости реакции, T – температура, R – универсальная газовая постоянная, E – энергия активации.
Аррениус предположил, что реагировать между собой могут только те молекулы, которые находятся в активной форме, образующиеся из обычных молекул. Такие молекулы были названы активными, а энергия, необходимая для перевода обычных молекул в активное состояние, энергией активации (рис. 9). Таким образом, энергией активации реакции называется минимальная энергия, которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции.
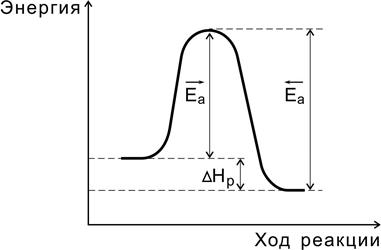
Рис. 9. Соотношение между энергиями активации прямой
и обратной реакций и теплового эффекта
В самом деле, в ходе химической реакции разрушаются одни и возникают другие молекулы, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии, и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование активированного комплекса. В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его не велико (10‾14 – 10‾11 с). При распаде комплекса образуются либо продукты реакции, либо исходные вещества.
После проведения интегрирования уравнения (39), уравнение Аррениуса принимает вид:
- определенное интегрирование в узком интервале температур
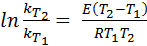 . (40)
. (40)
Данное уравнение позволяет рассчитать энергию активации по константам скоростей при двух температурах.
- неопределенное интегрирование:
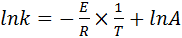 . (41)
. (41)
Построив график зависимости lnk=f(1/T)
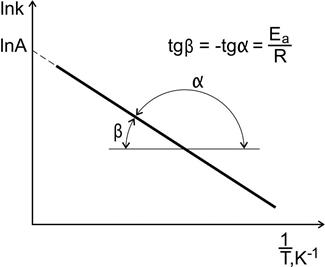
Рис. 10. Зависимость константы скорости реакции от температуры
По тангенсу угла наклона прямой к оси абсцисс вычисляют энергию активации.
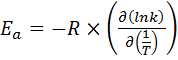 (42)
(42)
Отрезок, отсекаемый прямой на оси ординат при 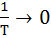 (
( 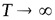 ), численно равен ln А (константа интегрирования).
), численно равен ln А (константа интегрирования).
В экспоненциальной форме уравнение Аррениуса имеет вид:
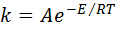 (43)
(43)
где А - предэкспоненциальный множитель. Размерность его совпадает с размерностью константы скорости. Для реакции первого порядка она имеет размерность частоты [c-1] и поэтому предэкспоненту называют также частотным фактором. Данную уравнение также можно использовать для расчета энергии активации, построив зависимость константы скорости реакции от температуры:
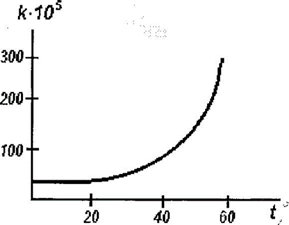
Рис. 11. Зависимость константы скорости реакции от температуры
Для заданной температуры на графике находят на зависимости точку к которой проводят касательную. По тангенсу угла наклона полученной прямой к оси абсцисс вычисляют энергию активации.
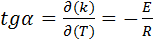 . (44)
. (44)
Для сложной реакции (протекающей в несколько стадий) параметр энергии активации в уравнении Аррениуса не равен энергии активации лимитирующей стадии, а представляет некоторую функцию энергии активации отдельных стадий или вообще эмпирическую величину.
ТЕОРИЯ АКТИВНЫХ СОУДАРЕНИЙ. СТЕРИЧЕСКИЙ ФАКТОР. Согласно теории соударений предэкспоненциальный множитель А (эмпирическая постоянная в уравнении Аррениуса) представляет собой фактор соударений z 0, который связан с общим числом двойных соударений z в 1 см3 в 1 с соотношением:
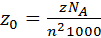 , (45)
, (45)
где n – число частиц (молекул) в 1 см3, NA/1000 – множитель для молярной концентрации, NA – постоянная Авагадро.
Величины z 0 и z могут быть рассчитаны на основании молекулярно-кинетической теории. Поэтому, заменив А на z 0 , константу скорости можно рассчитать по уравнению:
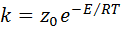 . (46)
. (46)
Однако такой расчет скорости реакции часто дает завышенные результаты, особенно для реакций в растворах. Для согласования расчетных данных с опытными в уравнение вводят дополнительный множитель Р, называемый стерическим или вероятностным фактором:
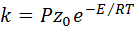 . (47)
. (47)
Следовательно,
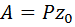 . (48)
. (48)
Подстановкам в уравнение (48) выражение для z 0 позволяет рассчитать константу скорости реакции. Для взаимодействия разнородных частиц константа скорости будет:
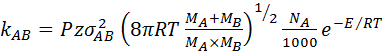 (49)
(49)
где МА и МВ – молекулярные массы молекул, 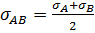 - усредненный диаметр (σА и σВ – диаметры молекул А и В), Е – энергия активации данной реакции.
- усредненный диаметр (σА и σВ – диаметры молекул А и В), Е – энергия активации данной реакции.
Стерический фактор Р зависит от природы реакции и может изменяться в пределах от 1 до 10-8, для некоторых ионных реакций, протекающих в растворах, стерический фактор может быть больше единицы. Стерический фактор учитывает вероятность того, что при столкновении частицы будут обладать необходимой для протекания реакции пространственной ориентацией.
Предэкспоненциальный множитель определяется экспериментально измерением констант скорости при нескольких температурах. Вычислив энергию активации, можно по значениям k при некоторой температуре рассчитать Р.
Вопрос о возможности теоретического расчета скоростей реакций на основании свойств реагирующих молекул решается теорией абсолютных скоростей реакций (теорией переходного состояния).
Эта теория является дальнейшим развитием теории активных столкновений, которая оказалась не в состоянии объяснить реакции, у которых стерический множитель намного больше единицы.
Теория бинарных столкновений рассматривает только результат столкновения, но не сам его акт. Теория же активированного комплекса рассматривает энергетику самого акта соударения молекул и образования, так называемого активированного комплекса, через который следует реакция. Иначе говоря, теория переходного состояния не отменяет, а углубляет и детализирует теорию активных столкновений, дополняя ее новыми понятиями.
Как и в теории активных столкновений, принимается, что только наличие избытка энергии у реагирующих частиц при столкновении приводит к химическому акту. Как этот избыток сказывается на состоянии молекул? Согласно теории переходного состояния, система, часто обладающая избытком энергии, переходит в менее устойчивое лабильное состояние. Через некоторое время после столкновения совершается перераспределение химических связей в исходных молекулах и образование конечных веществ, то есть совершается собственно химическое взаимодействие.
В теории вводится понятие о переходном состоянии,или активированном комплексе, которое является промежуточным между исходными и конечными веществами.
В отличие от обычных молекул, даже в неустойчивом, богатом энергией состоянии, переходное состояние характеризуется постоянно меняющимися во времени расстояниями между образующими его молекулами.
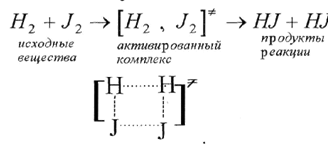
Рассмотрим с точки зрения теории переходного состояния реакцию
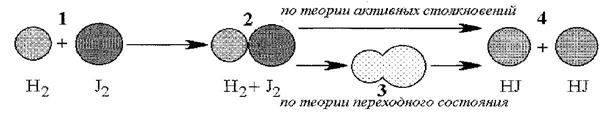
Рис. 12. Механизм реакции с точки зрения теории переходного состояния и теории активных столкновений
Молекулы водорода и йода, обладающие избытком энергии, равным энергии активации, сближаются до соприкосновения. В момент соударения молекулы (2) сблизились. Что происходит в момент сближения молекул, теория столкновений не учитывает. Согласно этой теории, после сближениядвойник (2) превращается в продукты реакции (4).
В действительности, очевидно, что простого сближения, соприкосновения молекул недостаточно, чтобы произошел акт реакции. Согласно теории активированного комплекса, для неизбежного превращения исходных молекул в продукты реакции молекулы водорода и йода, встретившись между собой, должны пройти через образование активированного комплекса, то есть через переходное состояние. В переходном состоянии одна молекула внедряется в другую, а перераспределяющиеся связи, то есть разрушающиеся и вновь образующиеся определенным образом ориентированы друг относительно друга. Такой комплекс можно изобразить так:
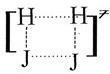
В этом комплексе исходные молекулы утратили свою индивидуальность. Если он образовался, то уже почти неизбежно превращается в продукты реакции, то есть механизм реакции можно представить в виде следующей схемы:
Хотя в теории и принимается, что активированный комплекс является как бы промежуточным образованием, через которое протекает реакция, но он не является молекулой или другим промежуточным соединением в обычном понимании. Это связано с тем, что реагирующие молекулы в переходном состоянии обладают максимальной энергией, где не может быть даже неустойчивого равновесного состояния.
Если активированный комплекс считать аналогичным обычной молекуле, то следует допустить наличие колебательных движений по всем связям с соответствующими им частотами колебаний. Однако это невозможно, так как в переходном состоянии все происходит иначе: по тем связям, которые исчезают, не совершается периодических колебаний. Процесс перераспределения связей исходных молекул, то есть разрушение старых связей и образование новых, совершается за промежуток времени, соответствующий частоте половине одного колебания, то есть периодического процесса колебания непроисходит: молекулы сближаются, образуют переходное состояние, оно совершает полколебания по координате реакции и распадается в виде продуктов реакции.
Таким образом, если в теории соударений принималось, что при столкновении молекулы деформировались или разбивались на осколки, которые, соединяясь, давали продукты реакции, то в стадии переходного состояния не предусматривается разрыв исходных молекул на атомы и образование из них продуктов реакции. Процесс образования новых связей происходит постепенно при сближении реагирующих молекул, что более энергетически выгодно. Если при реакции происходил бы полный разрыв старых связей, то энергия активации должна быть равна энергии связи наиболее прочной в данной молекуле. Тогда энергия активации была бы равна QH-H, то есть 106 ккал/моль. В действительности энергия активации почти вдвое ниже - 60 ккал/моль для реакции:
H2 +D2 →2 HD
Проследим за изменением потенциальной энергии системы атома А и молекулы ВС применительно к следующей реакции A + BC → AB + C (эта реакция типа свободных радикалов или атомов с молекулами).
Рассмотрим эту реакцию в рамках теории переходного состояния. Считают, что активированный комплекс – промежуточное состояние, образующееся при протекании всех химический реакций. Для теоретического предсказания скорости реакции необходимо задаться определенной конфигурацией активированного комплекса.
Для протекания реакции необходимо сближение атома А с молекулой ВС. При сближении их возникает электронное взаимодействие и увеличивается потенциальная энергия. Возрастание энергии продолжается вплоть до возникновения конфигурации А-В-С такой, что из нее получится либо АВ +С, либо ВС+А. Эта промежуточная конфигурация и есть активированный комплекс данного процесса, что можно представить в виде схемы процесса и графика изменения энергии в ходе процесса (рис. 13)
A + BC → A-B-C → AB + C
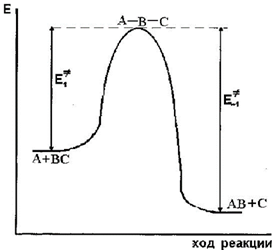
Рис. 13. Барьер потенциальной энергии для реакции A + BC →AB + C
При отделении атома В с образованием молекулы АВ или при обратном течении процесса, то есть возвращении к исходным веществам, потенциальная энергия вновь уменьшится.
Активированное состояние представляет точку максимума на диаграмме. Изменение потенциальной энергии при образовании активированного комплекса представляет собой энергию активации, где 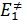 и
и 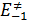 энергии активации прямого и обратного процессов соответственно.
энергии активации прямого и обратного процессов соответственно.
Эйринг и Поляни рассчитали потенциальную энергию вдоль пути реакции как функцию изменения расстояний ВС и АВ в процессе реакции.
Типичный путь для реакции A + BC → A - B - C → AB + C рассмотрим на диаграмме:
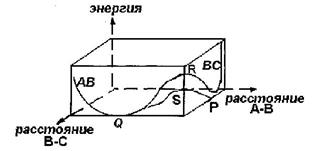
Рис. 14. Схема пути реакции A + BC → A - B - C → AB + C
Кривые потенциальной энергии двухатомных молекул ВС и АВ имеют минимум в точке Р и Q. Один из возможных путей реакции - PRQ. Молекула ВС распадается на атомы В и С, которые реагируют с А с образованием продуктов АВ и С. Энергия, необходимая для такой реакции, по меньшей мере, должна быть равна энергии диссоциации ВС. Если принять, что ВС - это ортоводород, то энергия активации должна быть равна 435 кДж/моль, и процесс будет очень медленным. Расчеты показали, что эта энергия меньше, и реакция идет по пути PSQ. Здесь требуется значительно меньшая энергия, сравнимая с экспериментальной величиной, то есть 35 кДж/моль.
Путь реакции представляют в виде контурной диаграммы, или диаграммы потенциальной поверхности реакции. В начальном положении атом А находится далеко от молекулы ВС, то есть расстояние от А до В намного больше, чем от В до С. По мере приближения атома А к молекуле ВС, например, по линии ВС начинается взаимодействие между атомом и молекулой, то есть изменение потенциальной энергии рассматриваемой системы.
Проследить за изменением расстояния между А, ВС, В и С и изменением потенциальной энергии при этом можно с помощью трехмерной диаграммы (рис. 14). На двух координатах откладывают расстояния, на третьей изменение энергии. В общем случае построение таких диаграмм требует довольно сложных квантово-механических расчетов, которые носят довольно приближенный характер.
С другой стороны, такую диаграмму можно изобразить на плоскости. По вертикали надо отложить энергию, соответствующую каждому из расстояний. Это можно сделать, как на топографических картах, соединив линиями точки с одинаковой энергией, то есть, построив проэнергетические линии. Цифры у линий обозначают уровень энергии (ккал). (рис.15).
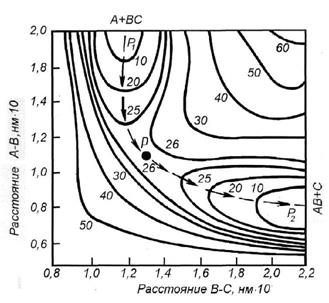
Рис. 15. Карта поверхности потенциальной энергии
реакции A + BC →AB + C
Такая диаграмма называется потенциальной поверхностью реакции.
На потенциальной поверхности видны две долины Р1 и Р2, соответствующие исходным и конечным продуктам. Чтобы перейти от Р1 к Р2, нужно передвигаться от точки к точке на схеме, пересекая проэнергетические кривые. Какой же путь выбрать? Очевидно, тот, на котором будет минимальный энергетический барьер, разделяющий обе долины, то есть путь с наименьшей энергией активации. Поскольку потенциальный барьер миновать нельзя, то наиболее выгодным будет путь, идущий через седловину (Р), то есть самую низкую точку перевала. Активированный комплекс образуется в перевальной точке, при этом атом В одинаково принадлежит как ВС, так и новой молекуле АВ. Получается так, что для образования активированного комплекса молекулы должны попасть на перевал, который и является областью образования переходного состояния. Далее активированный комплекс как бы скатывается с перевала в долину вдоль пути реакции с образованием продуктов.
Разность между потенциальной энергией исходных веществ (Р1) и энергией в точке перевала (Р) и есть энергия активации, при наличии которой молекулы способны образовывать переходное состояние и могут преодолеть перевал.
Сделаем мысленно разрез диаграммы по вертикали вдоль пути реакции и развернем затем этот разрез в одну плоскость. При этом получим уже знакомый потенциальный профиль реакции (рис. 16).
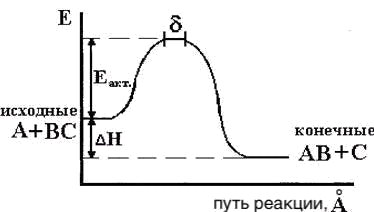
Рис. 16. Изменение потенциальной энергии системы вдоль координаты
реакции A + BC →AB + C во время элементарного акта
Подойти к расчету скорости химической реакции можно, используя следующий основной постулат теории: исходные вещества находятся в равновесии с переходным состоянием, которое разлагается с конечной скоростью. При этом допускается, что переходное состояние в термодинамическом смысле (и только!) можно рассматривать как обычную молекулу, то есть
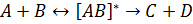 .
.
Рассмотрим основное уравнение теории переходного состояния, при этом сформулировав все основные положения и допущения теории переходного состояния.
1. В реакционной среде самопроизвольно образуется активированный комплекс – неустойчивое промежуточное соединение, у которого одна колебательная степень свободы переходит в поступательную степень свободы вдоль пути реакции.
2. Активированный комплекс находится в равновесии с исходными реагентами. Протекание реакции разрушения комплекса до продуктов реакции не влияет на это равновесие.
3. Протекание реакции не нарушает максвелл-больцмановское распределение активированных комплексов по скоростям и энергии. Это распределение сохраняется на протяжении всего времени протекания реакции.
4. Элементарный акт протекает плавно, адиабатно. В данном случае это означает, что движение ядер происходит значительно медленнее, чем движение электронов, то есть при движении вдоль координаты реакции электроны успевают перестроиться так, будто сами ядра неподвижны. Иначе говоря, не происходит существенного скачкообразного перехода электронов. Это условие во многих случаях выполняется. То есть процессы в большинстве случаев адиабатичны в квантово-механическом смысле.
5. Движение ядра рассматривается с позиций классической механики как движение частиц через потенциальный барьер, то есть исключаются туннельные (проникновение элементарных частиц сквозь энергетический барьер, то есть реакция может совершаться при Е < Е акт) безактивационные переходы.
Основное уравнение теории переходного состояния (ТПС)может быть записано в виде:
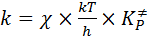 , (50)
, (50)
где k – константа Больцмана, h – постоянная Планка, 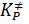 - константа равновесия процесса образования активированного комплекса,
- константа равновесия процесса образования активированного комплекса, 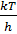 - частотный множитель, характеризует частоту колебания активированного комплекса в направлении протекания реакции, χ – коэффициент трансмиссии, который показывает вероятность прохождения активированного комплекса через вершину активационного барьера.
- частотный множитель, характеризует частоту колебания активированного комплекса в направлении протекания реакции, χ – коэффициент трансмиссии, который показывает вероятность прохождения активированного комплекса через вершину активационного барьера.
Для процесса активации константа равновесия выражается уравнением:
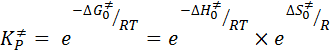 , (51)
, (51)
Преобразовав уравнение (50) с учетом уравнения (51), получаем:
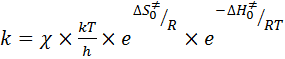 , (52)
, (52)
Теплота активации связана с энергией активации уравнением:
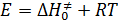 (53)
(53)
Подставляя уравнение (53) в уравнение (52) получаем основное уравнение ТПС:
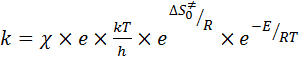 , (54)
, (54)
где 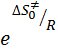 – вероятностный фактор или энтропийный фактор. Энтропийный фактор может принимать различные значения:
– вероятностный фактор или энтропийный фактор. Энтропийный фактор может принимать различные значения:
· если конфигурация активированного комплекса не меняется, т.е. такая же как у исходных молекул, то 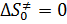 , следовательно
, следовательно 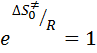 .
.
· если 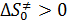 , то конфигурация активированного комплекса более вероятна, чем у исходных веществ, а это может приводить к тому, что активированный комплекс образуется, а распадаться не будет.
, то конфигурация активированного комплекса более вероятна, чем у исходных веществ, а это может приводить к тому, что активированный комплекс образуется, а распадаться не будет.
· если 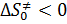 , то образуются конечные продукты.
, то образуются конечные продукты.
Используя уравнения (47), (48) и (54) можно рассчитать стерический (энтропийный или вероятностный) фактор:
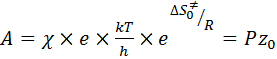 , (55)
, (55)
и при χ=1
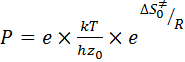 , (56)
, (56)
т.е.
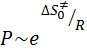 . (57)
. (57)
Таким образом, теория переходного состояния позволяет вычислить предэкспоненциальный множитель.
КОНТРОЛЬНЫЕ ВОПРОСЫ ПО КИНЕТИКЕ
1. Что изучает химическая кинетика? Какова ее практическая цель?
2. Дайте определение гомогенных и гетерогенных реакций. Как находятся их скорости?
3. Может ли скорость реакции быть отрицательной величиной? Ответ мотивируйте.
4. Чем отличается средняя скорость реакции от скорости, которая определяется как производная dc/dτ?
5. От каких факторов зависит скорость химических реакций? Дайте определение закона действующих масс. В равенствах, выражающих этот закон, отражена ли зависимость скорости реакции от природы реагирующих веществ?
6. Каков физический смысл константы скорости реакции? Какова ее размерность? От каких параметров зависит константа скорости реакции?
7. Зависит ли константа скорости от температуры, природы реагирующих веществ и их концентраций?
8. Если для двух реакций: а) одинаковы концентрации реагирующих веществ и температура, то чем определяется различие в их скоростях; б) одинаковы константы скорости, то при каких условиях будут одинаковы их скорости?
9. Что означает термин «механизм химической реакции»?
10. Дайте определение понятиям «порядок реакции по веществу» и «порядок реакции в целом». Связаны ли порядки реакции по отдельным веществам со стехиометрическими коэффициентами брутто-реакции? Ответ мотивируйте и поясните на примере.
11. Объясните термин «молекулярность реакции». В чем заключается различие «порядка» и «молекулярности» химических реакций? В каком случае эти величины могут быть равными?
12. Напишите выражение для скорости следующих химических реакций:
а) 2NO(газ)+ О2(газ)= 2NO2(газ),
б) СаО(кр)+ СО2(газ)= СаСО3(кр),
в) FеО(кр)+ Н2(газ)= Fе(кр)+ Н2О(ж).
Перечислите способы, которыми можно увеличить и уменьшить скорость данной химической реакции.
13. Какой формулой выражается правило Вант-Гоффа? Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения? Почему повышение температуры увеличивает скорость реакции? Какой фактор определяет возможность осуществления химической реакции при столкновении частиц реагирующих веществ?
14. Какие молекулы называют активными? Что называют энергией активации и активным комплексом? На основании анализа уравнения Аррениуса сделайте вывод о влиянии энергии активации на константу скорости реакции? При каких условиях могут осуществляться реакции, характеризующиеся высоким значением энергии активации?
15. Какие реакции называют необратимыми, обратимыми? Определите понятия прямой и обратной химической реакции.
16. Одинаковы или различны значения констант скоростей для прямой и обратной реакции? Объясните.
17. Как изменяются во времени скорости прямой и обратной реакции? Чем это обусловлено и в какое состояние приводит данную систему?
18. Какие из следующих факторов влияют на скорость реакции: природа реагирующих веществ, концентрация реагирующих веществ, катализатор, растворитель, температура?
19. В каких случаях скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени?
20. Какие из следующих факторов влияют на константу скорости химической реакции: природа реагирующих веществ, концентрация реагирующих веществ, катализатор, растворитель, температура?
21. Какие экспериментальные данные необходимы для определения порядка реакции?
22. Выведите выражение для периода полупревращения (полураспада) исходных веществ для реакции третьего порядка, если исходные концентрации реагирующих веществ одинаковы.
23. Выведите для реакции n-го порядка кинетическое уравнение и период полураспада.
24. Укажите размерность константы скорости реакции второго порядка.
25. Какая из односторонних реакций заканчивается быстрее при одинаковых исходных концентрациях и одинаковых константах скорости: реакция первого, второго или третьего порядка?
26. Одинаковы ли порядки реакций: Напишите механизмы этих реакций.
27. Сформулируйте главную задачу, которую ставит перед собой теория абсолютных скоростей химических реакций.
28. Как рассчитать скорость реакции по теории активных столкновений? Какие виды энергии включает в себя энергия активации?
29. Как связаны между собой теплота активации и экспериментально определяемая энергия активации Еакт. для реакции?
30. Какой смысл несет стерического фактора Р согласно теории абсолютных скоростей химических реакций?
31. Что включает в себя предэкспоненциальный множитель k0 в уравнении Аррениуса по теории соударений? Запишите в общем виде уравнение для его расчета.
32. Что такое энтропия активации? Как ее можно рассчитать?
33. Может ли и в каких случаях энтропия активации быть меньше нуля?
34. Что вы понимаете под переходным состоянием?
35. Напишите основное уравнение теории переходного состояния в термо-динамической форме для процесса, протекающего при Р = const и T = const,
36. Что учитывает трансэмиссионный коэффициент в уравнении теории переходного состояния?
Дата добавления: 2021-04-24; просмотров: 429; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
