Методы определения порядка реакции
Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если не известен механизм реакции. Порядок реакции определяют, используя экспериментальные данные об изменении концентрации реагирующих веществ со временем. Методы определения порядка подразделяют на интегральные и дифференциальные в зависимости от того, используются интегральные или дифференциальные кинетические уравнения (см. табл. 1) для обработки опытных данных.
К интегральным методам относятся метод подстановки (аналитический и графический), метод времени полупревращения и метод Оствальда-Нойеса.
Метод подстановки заключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от нулевого до третьего) и рассчитывают константу скорости. Если для выбранного порядка рассчитанные значения k приблизительно постоянны (с учетом разброса экспериментальных данных), то изучаемая реакция имеет данный порядок. Если же значения константы скорости систематически возрастают или убывают, то расчет повторяют для другого порядка. Если ни одно из кинетических уравнений не дает удовлетворительного результата, то есть порядок реакции не является целым, это означает, что реакция протекает по более сложному механизму.
Графический вариант метода подстановки заключается в представлении экспериментальных данных в соответствующих координатах с целью получения линейной зависимости текущей концентрации от времени.
Для 0 порядка:  . (10)
. (10)
Для 1 порядка: 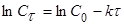 . (11)
. (11)
Для 2 порядка:  . (12)
. (12)
Для 3 порядка: 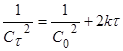 . (13)
. (13)
Если в координатах, соответствующих одному из порядков, получается линейная зависимость от времени, то изучаемая реакция имеет данный порядок. Одновременно из тангенса угла наклона прямой в этом случае можно получить значение константы скорости (рис. 1, 2, 3, 4).
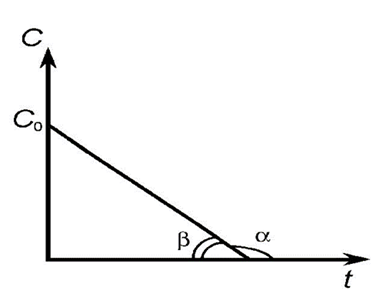
Рис. 1. Зависимость концентрации исходного вещества от времени для реакции нулевого порядка

Рис. 2. Зависимость lnC = f(t) для реакции первого порядка
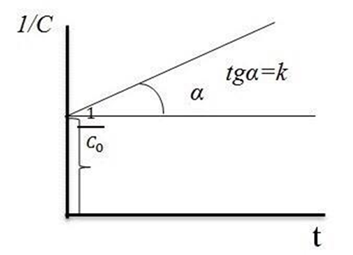
Рис. 3. Зависимость 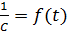 для реакции второго порядка
для реакции второго порядка

Рис. 4. Зависимость 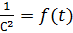 для реакции третьего порядка
для реакции третьего порядка
Метод подстановки дает надежные результаты для больших значений степени превращения исходных веществ.
Метод времени полупревращения. Период полураспада для реакций различного порядка по-разному зависит от начальной концентрации реагентов (см. табл. 1). Для реакции нулевого порядка τ1/2 прямо пропорционален начальной концентрации С0, для реакции первого порядка – не зависит от начальной концентрации С0, для реакции второго порядка – обратно пропорционален С0, а для реакции третьего порядка – обратно пропорционален С02. Проводят эксперименты с различными начальными концентрациями реагирующих веществ, определяют τ1/2 , строят графические зависимости τ1/2 = f(С0) в соответствующих координатах. Получение линейной зависимости свидетельствует о том, что реакция имеет данный порядок, а угловой коэффициент прямой позволяет найти константу скорости реакции.
Если порядок реакции равен дробной величине, то его можно определить графически по времени полупревращения реакции n-ного порядка
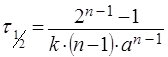 . (14)
. (14)
Логарифмируя это уравнение, получим уравнение прямой
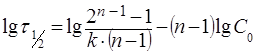 . (15)
. (15)
По экспериментальным данным о τ1/2 и С0 строят график в координатах lgτ1/2 - lg(С0) – (рис. 5), получают прямую линию, тангенс угла наклона которой к оси абсцисс tgα = n – 1 n = tgα + 1.
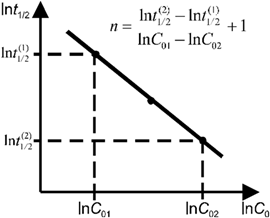
Рис.5. Зависимость 
В методе Оствальда-Нойеса используют зависимость времени превращения τα от начальной концентрации исходного вещества, где α - определенная глубина протекания реакции (α = 1/2, 1/3, 1/4 и т. д.). Порядок реакции рассчитывают по следующему уравнению:
 . (16)
. (16)
Частным случаем метода Оствальда-Нойеса является метод определения порядка реакции по периоду полупревращения:
 . (17)
. (17)
Методы Оствальда-Нойеса и времени полураспада позволяют определять любые порядки реакций, включая дробные и отрицательные.
К дифференциальным методам определения порядка относятся метод избытка или изоляции Оствальда и метод Вант-Гоффа.
Если кинетическое уравнение реакции имеет вид
 , (18)
, (18)
то для определения частного порядка по одному из веществ используют метод избытка или изоляции Оствальда. Суть метода состоит в том, что зависимость скорости реакции от начальной концентрации одного из реагентов (например, вещества А) изучают при большом избытке второго реагента В. В этом случае концентрация вещества В остается в течение реакции практически постоянной, и уравнение (18) приобретает вид
 , (19)
, (19)
где 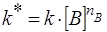 .
.
Логарифмируя уравнение (19), получим уравнение прямой линии
 , (20)
, (20)
из тангенса угла наклона которой определяют порядок реакции, а из отсекаемого отрезка – константу скорости (рис. 6). Различные значения υ и 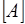 могут быть получены из одной кинетической кривой
могут быть получены из одной кинетической кривой 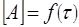 (рис. 7), где скорость реакции в данный момент времени рассчитывается как тангенс угла наклона касательной в этой точке.
(рис. 7), где скорость реакции в данный момент времени рассчитывается как тангенс угла наклона касательной в этой точке.
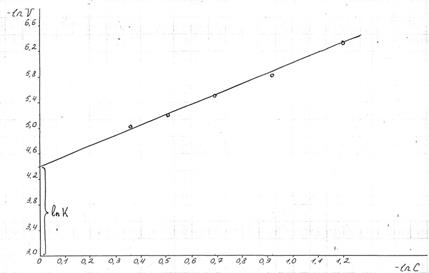
Рис. 6. Зависимость lnυ=f(lgC)
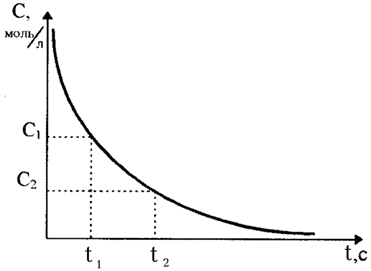
Рис. 7. Зависимость изменения концентрации вещества во времени
Метод Вант-Гоффа также основан на уравнении (20) и позволяет по двум значениям скорости реакции при двух концентрациях вещества А определить порядок реакции:
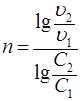 . (21)
. (21)
Кинетика сложных реакций
При изучении кинетики сложных реакций используют принцип независимого протекания процесса: если в системе одновременно протекают несколько простых реакций, то скорость каждой из них пропорциональна концентрациям только тех веществ, которые участвуют в данной реакции.
Иначе говоря, каждая стадия сложной реакции подчиняется основному постулату формальной кинетики (уравнения 4 и 5) независимо от других стадий с учетом направления процесса
Основные типы сложных реакций рассмотрим на примере реакций первого порядка.
1) Обратимые реакции – реакции, протекающие одновременно в двух противоположных направлениях:
 .
.
Кинетическое уравнение записывается следующим образом:
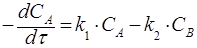
 (22)
(22)
и с учетом обозначений, введенных в пункте 1.2, принимает вид:
 , (23)
, (23)
или 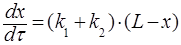 , (24)
, (24)
где постоянная L отвечает равновесному состоянию системы и может быть рассчитана через константы скорости прямой и обратной реакций k1 и k2 или через константу равновесия  по следующему уравнению:
по следующему уравнению:
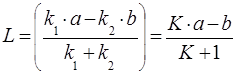 . (25)
. (25)
В свою очередь константа равновесия обратимой реакции может быть вычислена из уравнения изотермы химической реакции с использованием стандартных термодинамических таблиц.
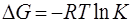 .
.
Решение уравнения (24) позволяет рассчитать сумму констант скорости прямой и обратной реакции:
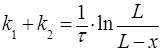 . (26)
. (26)
2) Параллельные реакции – реакции, в которых исходное вещество реагирует сразу по нескольким направлениям:
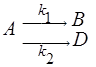 .
.
Кинетическое уравнение записывается с учетом принципа независимости:
 , (27)
, (27)
а решение этого уравнения сходно с интегральными уравнениями для необратимой реакции первого порядка
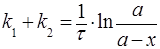 , (28)
, (28)
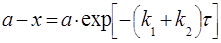 . (29)
. (29)
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
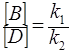 . (30)
. (30)
3) Последовательные реакции – реакции, протекающие через образование неустойчивых промежуточных веществ:
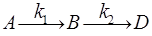 .
.
Применим к такой системе закон действующих масс и принцип независимого протекания процесса, если в начальный момент времени в реакционном объеме есть только реагент А:
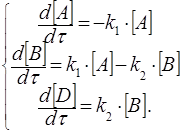 (31)
(31)
Решение системы уравнений (31) позволяет рассчитать концентрации всех веществ как функции времени аналитически
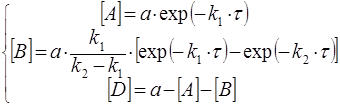 (32)
(32)
и интерпретировать полученные зависимости графически (рис. 11).
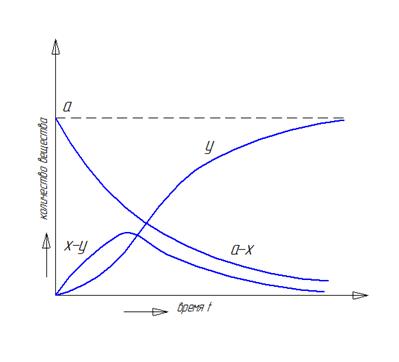
Рис. 8 Зависимость концентраций веществ от времени в системе двух последовательных реакций первого порядка, где (а-х) – СА, (х-у) – СВ, у - СD.
Концентрация исходного вещества А уменьшается по экспоненте. Концентрация промежуточного вещества В достигает максимума в точке
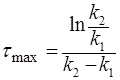 , (33)
, (33)
и величина этого максимума определяется отношением констант k1/k2.
Если оно мало (k1>>k2), то промежуточный продукт быстро накапливается и медленно расходуется, его максимальная концентрация почти достигает исходной концентрации реагента А. Если же оно мало (k1<<k2), то промежуточный продукт не успевает накапливаться, и его концентрация в любой момент времени близка к нулю. В этом случае для анализа кинетических уравнений можно использовать принцип стационарного протекания процесса,согласно которому скорость образования промежуточного вещества в любой момент времени равна скорости его расходования.
Кинетическая кривая для продукта D имеет S-образную форму с точкой перегиба. Как нетрудно показать из системы уравнений (31), время достижения точки перегиба равно τmax, то есть совпадает со временем достижения максимальной концентрации промежуточного продукта В. До точки перегиба продукт D быстрее образуется, чем расходуется, а после неё скорость его образования постоянно уменьшается. При малых временах концентрация D настолько мала, что его нельзя обнаружить в системе – индукционный период.
Если промежуточный продукт В неустойчив (k1<k2), то слагаемым 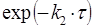 в с кинетическом уравнении (32) для [В] можно пренебречь, тогда
в с кинетическом уравнении (32) для [В] можно пренебречь, тогда
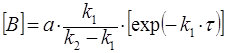 , (34)
, (34)
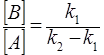 , (35)
, (35)
то есть отношение концентраций промежуточного продукта и реагента становится постоянным – переходный период.
Если лимитирует первая стадия (k1<<k2), то в уравнении (35) можно пренебречь величиной k1 в знаменателе, что приводит к выражению:
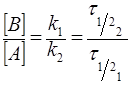 . (36)
. (36)
Это означает, что отношение концентраций промежуточного и исходного веществ равно отношению их периодов полураспада. Такое состояние называют вековым равновесием. Оно устанавливается при временах мого больших периода полураспада промежуточного соединения.
Дата добавления: 2021-04-24; просмотров: 2482; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
