В состав фракции бета-глобулинов не входят:
Https://biokhimija.ru/klinicheskajabiohimija.html
ПРИ ВЫПОЛНЕНИИ РАБОТЫ МОЖНО ПОЛЬЗОВАТЬСЯ ИСТОЧНИКОМ ПО ССЫЛКЕ (информация изложена в простой форме), а также лекцией. При ответе на тесты нужно давать пояснение к выбранному варианту (это поможет усвоить материал и почитать дополнительно).
Вопрос 1. Транспортные формы аммиака, как образуются.
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аммиак от мышц и стенки кишечника. Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы из глутаминовой кислоты:глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+.
С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений
Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот.
|
|
|
При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования, катализируемой глутаматдегидрогеназой:
Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой.
Глутамат + Пируват 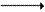 α-Кетоглутарат + Аланин
α-Кетоглутарат + Аланин
Аланин выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат.
α-Кетоглутарат + Аланин 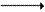 Глутамат + Пируват
Глутамат + Пируват
Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевиную, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пируват.
|
|
|
Вопрос 2. С какими механизмами связаны нарушения вызываемые аммиаком.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
|
|
|
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной систем
К белкам плазмы относятся
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
а) кератины - семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину.
б) эластин - белок соединительной ткани, обладающий эластичностью. Эластин является фибриллярным белком.
в) глобулины - семейство глобулярных белков крови, имеющих более высокую молекулярную массу и меньшую растворимость в воде, чем альбумины.
г) склеропротеины - белковые вещества, несущие в организме механические функции из них построены рога, копыта и волосы животных
д) коллагены - фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий её прочность и эластичность.
|
|
|
2. Белкам плазмы не присущи функции:
Многообразие белков крови приводит к тому, что они обладают многочисленными функциями:
а) сохранения постоянства коллоидно-осмотического давления - альбумины
б) гемостатическая - специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.)
в) участие в иммунном ответе – иммуноглобулины, факторы системы комплемента, трансферрин и пропердин.
г) транспортная (связывают и транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) – альбумины и другие белки.
д) рецепторная – белки плазмы крови не принимают участия в передаче сигналов.
3. Альбумины не участвуют в:
Его основными функциями являются формирование онкотического давления, транспорта билирубина, анионных лекарств, жирных кислот, альдостерона, гема, кальция, триптофана. Альбумин считается основным источником аминокислот.
а) активации липопротеиновой липазы
б) регуляции концентрации свободного кальция в плазме
в) транспорте жирных кислот
г) регуляции концентраций свободных гормонов
д) сохранения постоянства внутренней среды
4. Во фракции альфа-1 и альфа-2-глобулинов не входит:
а) фибриноген – бета-глобулин
б) гаптоглобин – альфа-2-глобулин
в) a2-макроглобулин – альфа-2-глобулин
г) a-фетопротеин – альфа-1-глобулин
д) щелочная фосфатаза – альфа-2-глобулин
В состав фракции бета-глобулинов не входят:
Фракция β-глобулинов содержит: трансферрин, гемопексин, лактоферрин, сексстероид-связывающий глобулин (SHBG), компоненты комплемента С1-С4, С9, плазминоген, проконвертин, фибриноген, β-липопротеины. В эту фракцию белков также входят липидпереносящие белки: β-липопротеины (липопротеины низкой плотности) и преβ-липопротеины (липопротеины очень низкой плотности).
а) фибриноген
б) липопротеиды
в) иммуноглобулин G - иммуноглобулин
г) трансферрин
д) бета-2-микроглобулин
6. Диспротеинемии это: нарушение соотношения между отдельными белковыми фракциями при нормальном общем содержании белков. Как правило, нарушения возникают между отдельными фракциями глобулинов (дисглобулинемии). Диспротеинемии отмечают при многих острых воспалительных процессах, диффузных заболеваниях соединительной ткани, аутоиммунных заболеваниях (увеличивается содержание α2-глобулинов); ряд хронических и некоторые острые воспалительные процессы, нефроз, стресс сопровождаются увеличением уровня фибриногена.
а) увеличение общего белка
б) уменьшение общего белка
в) снижение фибриногена
г) нарушение соотношения фракций белков плазмы
д) все перечисленное верно
7. В составе гамма-глобулинов больше всего представлено: IgG циркулируют в крови, составляют 80% всех антител.
а) Ig M
б) Ig G
в) Ig A
г) Ig E
д) Ig D
Дата добавления: 2021-07-19; просмотров: 58; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
