ГЛАВА V . Цитогенетика человека
Цитогенетика – наука о связи внутриклеточных структур и наследственности. Она находится на стыке генетики (науки о наследственности и изменчивости) и цитологии (науки о клетке).
5.1 Внутриклеточные носители наследственной информации у человека - ядро и митохондрии
Ядро (лат. nucleus) — органелла эукариотической клетки, содержащая молекулы ДНК, которые несут генетическую информацию. В ядре происходят важнейшие для жизни процессы: репликация — удвоение молекул ДНК, а также транскрипция — синтез молекул РНК на молекуле ДНК. Здесь же синтезированные молекулы РНК подвергаются ряду модификаций, и только после этого выходят в цитоплазму. В особых структурах внутри ядра – ядрышках – происходит образование субъединиц рибосом.
Ядро отделено от цитоплазмы ядерной оболочкой, образованной за счёт расширения и слияния друг с другом цистерн эндоплазматической сети таким образом, что у ядра образовались двойные стенки за счёт окружающих его узких компартментов. Полость ядерной оболочки называется люменом или перинуклеарным пространством. Внутренняя поверхность оболочки ядра подстилается ядерной ламиной - жёсткой белковой структурой, образованной белками-ламинами, к которой прикреплены нити хромосомной ДНК. Ламины прикрепляются к внутренней мембране ядерной оболочки при помощи заякоренных в ней трансмембранных белков — рецепторов ламинов. В местах слияния внутренней и внешней мембран ядерной оболочки образуются так называемые ядерные поры, через которые происходит обмен веществ между ядром и цитоплазмой. Пора не является дыркой в ядре. Это сложная структура, организованная несколькими десятками особых белков — нуклеопоринов. С помощью электронной микроскопии было установлено, что ядерная пора представляет собой структуру, состоящую из восьми связанных друг с другом белковых гранул с внешней, и восьми - с внутренней стороны ядерной оболочки.
|
|
|
Ядрышко – структура, находящаяся внутри ядра, не имеющая собственной мембранной оболочки, однако хорошо различимая как под световым, так и под электронным микроскопом. Основная функция ядрышка - синтез рибосом. В хромосомах имеются так называемые ядрышковые организаторы - специальные участки, содержащие гены рибосомной РНК (рРНК), вокруг которых и формируются ядрышки. В ядрышке полимераза I синтезирует рРНК. После созревания этой РНК происходит сборка рибосомных субчастиц. В ядрышке локализуются белки, принимающие участие в этих процессах. Для некоторых из этих белков характерно наличие особой аминокислотной последовательности — сигнала ядрышковой локализации. Следует отметить, что в ядрышке локализуется около 600 видов различных белков. Это самая высокая концентрация белка в клетке. Считается, что для осуществления функций ядрышка необходима лишь небольшая часть этих белков, а остальные попадают туда не специфически.
|
|
|
Применение методов электронной микроскопии позволило выделить в ядрышке несколько субкомпартментов: так называемые фибриллярные центры, окруженные участками плотного фибриллярного компонента, где и происходит синтез рРНК, и гранулярные компоненты, которые располагаются снаружи от плотного фибриллярного компонента и представляют собой скопление созревающих рибосомных субчастиц.
При делении клеток отдельные молекулы ДНК подвергаются компактизации, становятся различимы хромосомы – нуклеопротеиновые комплексы, состоящие из двух хроматид, соединенных центромерой – первичной перетяжкой (Рисунок V, 1). Поскольку хроматиды являются результатом репликации (удвоения) одной молекулы ДНК, их называют сестринскими. Каждая хроматида разделена центромерой на две части – плечи. Обычно плечи хромосом не равны по длине, выделяют короткое (обозначается латинской буквой p) и длинное плечо (обозначается буквой q). Отношение длины короткого плеча к длине всей хромосомы, называют центромерным индексом. Различают метацентрические хромосомы (центромерный индекс 0,35 – 0,50), субметацентрические (0,25 – 0,35) и акроцентрические (< 0,25). Концевые районы хромосом называются теломеры.
|
|
|
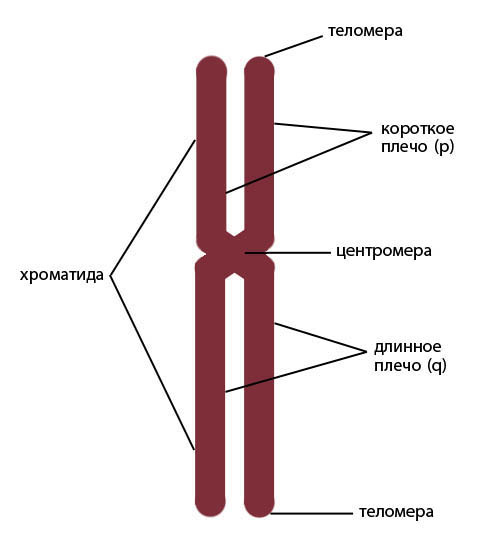
Рисунок V , 1. Схематическое изображение хромосомы.
Митохондрии — органеллы, имеющиеся в цитоплазме многих эукариотических клеток. Именно в митохондриях происходит синтез АТФ - основного источника химической энергии клетки. Эффективность работы митохондрий очень высока. На фотографиях митохондрий видно обилие внутренних мембран (Рисунок V, 2). Количество и форма митохондрий сильно различаются в разных тканях и зависит от интенсивности обмена веществ. Например, в одной клетке печени млекопитающих может быть 1000-1500 митохондрий.

Рисунок V , 2. Электронная микрофотография среза митохондрии.
Оболочка митохондрий состоит из двух мембран, между которыми имеется межмембранное пространство. Пространство, отграниченное внутренней мембраной, называется матриксом. В матриксе располагаются митохондриальные ДНК, РНК и рибосомы, содержатся ферменты, участвующие в цикле Кребса, протекают реакции окисления жирных кислот. Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности. На обращенной к матриксу стороне внутренней мембраны митохондрий локализуются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная мембрана митохондрий имеет маленькие отверстия, образованные специальными белками, через которые могут проникать небольшие молекулы и ионы. Внутренняя мембрана таких отверстий не имеет. В местах соприкосновения наружной и внутренней мембран находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
|
|
|
Митохондриальный геном человека представлен кольцевой молекулой ДНК длиной 16569 п.н. (пар нуклеотидов), которая содержит 37 генов (13 из них кодируют белки, функционально связанные с энергетическим обменом, 22 – транспортные РНК и 2 – рибосомальную РНК). ДНК митохондрий наследуется исключительно по материнской линии. В митохондриальной ДНК наблюдается высокая частота мутаций. Мутации митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека, обычно связанных с тяжелыми нарушениями обмена веществ.
5.2 Митоз, мейоз и особенности созревания половых клеток человека
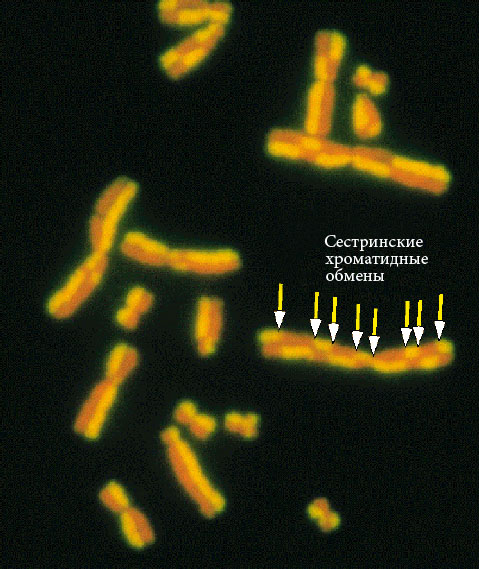
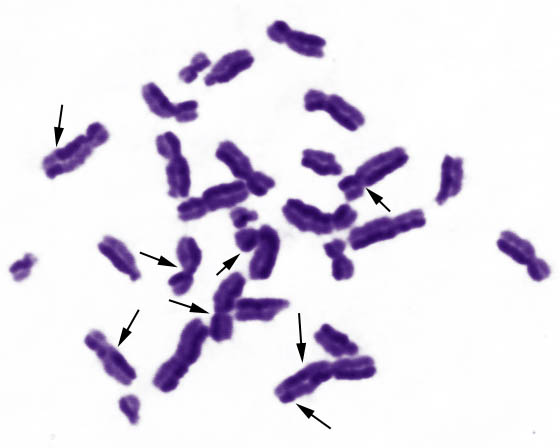
Для большинства нормальных клеток человека характерно деление путем митоза – упорядоченного расхождения хроматид к полюсам клетки при помощи веретена деления с последующим формированием генетически идентичных дочерних клеток. Клеточный цикл состоит из интерфазы – периода между двумя клеточными делениями - и митоза (Рисунок V, 3). Интерфаза включает фазу G1 – синтез белка, предшествующий удвоению ДНК, фазу S – репликация (удвоение) ДНК и фазу G2 – пострепликационный синтез белка. Иногда клетки переходят в фазу G0 – пролиферативного покоя, когда окончательно специализированные клетки перестают делиться. На стадии S часто происходят сестринские хроматидные обмены (СХО, Рисунок V, 4), частота которых зависит от внешних влияний на клетку. Специальные методы окрашивания позволяют выявлять СХО. Повышенная частота СХО служит индикатором вредных влияний на клетки.
Митоз включает следующие стадии:
I – Профаза. Конденсация хроматина приводит тому, что хромосомы становятся видимыми, сестринские хроматиды тесно прилежат друг ко другу. Ядрышко исчезает, кариолемма (оболочка ядра) растворяется, формируется веретено деления.
II – Метафаза. Хромосомы располагаются в экваториальной плоскости клетки. К центромерам прикреплены нити ахроматинового веретена, другие концы которых закреплены в центриолях на полюсах клетки. Хроматиды начинают отделяться одна от другой, оставаясь соединенными только в центромерах. Центромеры разъединяются и сестринские хроматиды начинают расхождение к полюсам клетки.
III – Анафаза. Сестринские хроматиды расходятся к полюсам клетки.
IV – Телофаза. Происходит деконденсация хроматина, формируются дочерние ядра, веретено деления дезинтегрируется, появляется перетяжка между дочерними клетками.
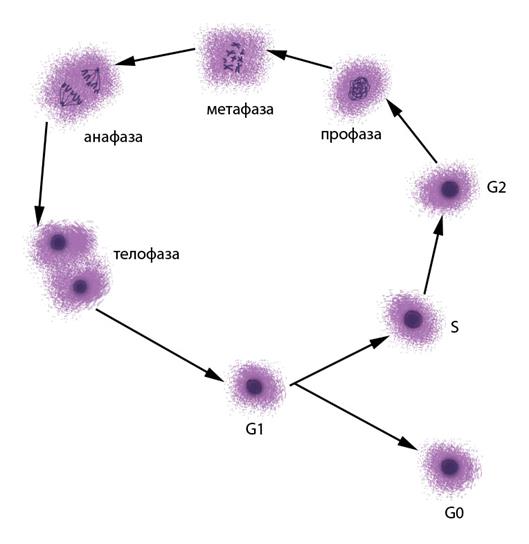
Рисунок V , 3. Стадии клеточного цикла.
Хромосомы лучше всего видны на стадии метафазы, поэтому основным методом цитогенетики является метафазный анализ. Для того чтобы накопить достаточное количество клеток на стадии метафазы, используют колхицин – вещество, которое растворяет трубочки ахроматинового веретена, препятствуя агрегации молекул тубулина, из которого состоят микротрубочки.
А.
Б.
Рисунок V , 4. Сестринские хроматидные обмены.
А. Флуоресцентный вариант. По материалам сайта http://www.crios.be/genotoxicitytests/sister_chromatid_exchange_test.htm.
Б. Нефлуоресцентный вариант. Фотография Е.Г. Нероновой.
С точки зрения передачи наследственной информации все клетки можно подразделить на два типа – генеративные (половые), то есть те, которые участвуют в формировании генотипа потомков, и соматические (от лат. soma – тело), гены которых не передаются потомкам. Если для соматических клеток характерно митотическое деление, то для формирования половых клеток (гамет) необходим мейоз. Мейоз (от греческого meiosis - уменьшение) – это тип деления клетки, при котором число хромосом уменьшается вдвое – каждая дочерняя клетка получает по гаплоидному набору хромосом, то есть набору, где каждая хромосома представлена одним гомологом из двух, пришедших от каждого из родителей индивидуума. Гаплоидное число хромосом обозначается n, у человека n = 23. Такое число хромосом имеют яйцеклетки и сперматозоиды. Соматические клетки содержат диплоидное число хромосом 2n = 46. Биологическое значение мейоза заключается (1) в формировании гаплоидных клеток, которые при слиянии могут дать начало диплоидному организму и (2) в рекомбинации хромосом - кроссинговер происходит в профазе I, а в анафазе I гомологичные хромосомы случайным образом расходятся к полюсам клетки), что служит для увеличения генетического разнообразия индивидуумов.
Мейоз включает два деления – редукционное, когда вдвое уменьшается число хромосом, и эквационное – обычный митоз, когда вдвое уменьшается число хроматид (Рисунок V, 5). Редукционное деление (деление I) включает профазу I, метафазу I, анафазу I и телофазу I. В профазе I выделяют следующие стадии:
- Лептотена (стадия тонких нитей). Становятся видимыми длинные хромосомные нити.
- Зиготена. Начинается спаривание (коньюгация) гомологичных хромосом. Образуются биваленты – спаренные гомологичные хромосомы. Каждый бивалент состоит из четырех хроматид. Половой бивалент резко отличается от других – X- и Y-хромосомы соединены торцами. Формируются синаптонемальные комплексы – характерные структуры в местах контактов хроматид, имеющие двухслойное строение.
- Пахитена. Происходит дальнейшая конденсация хромосом.
- Диплотена. Распадаются синаптонемальные комплексы. Происходит разделение несестринских хроматид, которые остаются связанными друг с другом в отдельных точках, где образуются Х-образные структуры – хиазмы.
- Диакинез. Происходит терминализация хиазм – хиазмы сдвигаются к теломерам. Происходит полное разделение гомологичных хромосом.
В конце метафазы I гомологичные хромосомы начинают расхождение к полюсам клетки. Анафаза I и телофаза I проходят аналогично анафазе и телофазе обычного митотического деления.
Эквационное деление является обычным митотическим делением гаплоидной клетки. Оно включает профазу II, метафазу II, анафазу II и телофазу II.
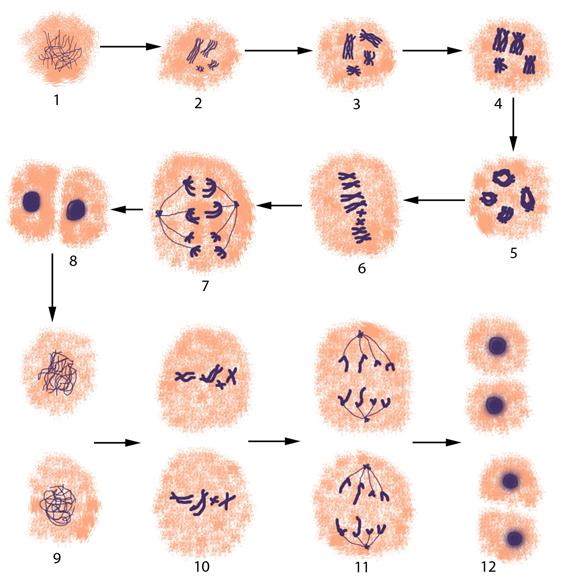
Рисунок V , 5. Обобщенная схема мейотического деления. 1-5 – профаза I, 1 – лептотена, 2 – зиготена, 3 – пахитена, 4 – диплотена, 5 – диакинез, 6 – метафаза I, 7 – анафаза I, 8 – телофаза I, 9 – профаза II, 10 – метафаза II, 11 – анафаза II, 12 – телофаза II
У человека формирование мужских половых клеток – сперматозоидов и женских – яйцеклеток имеет существенные биологические особенности (Рисунки V, 6 и V, 7).
Начиная с момента полового созревания (в постпубертантный период) сперматогенез у мужчин происходит постоянно. В семенниках сперматоциты – клетки-предшественники сперматозоидов - подвергаются мейотическому делению. Из одного сперматоцита получается четыре сперматозоида, каждый из которых содержит плотно упакованный гаплоидный набор хромосом и митохондрию, которая служит для выработки энергии для жгутика. Жгутик позволяет сперматозоиду быстро передвигаться в жидкой среде. Следует отметить, что от зачатия до начала мейоза в семенниках клетки-предшественники сперматозоидов проходят большое число митотических делений, в ходе которых могут накапливаться мутации. В этом проявляется эволюционная роль мужского пола как носителя наследственной изменчивости. Так при сравнении последовательностей ДНК хромосом шимпанзе и человека выяснилось, что быстрее всего накапливаются замены нуклеотидов именно в Y-хромосоме, что служит прекрасной иллюстрацией этого положения.
Эволюционная роль женского пола как хранителя уже устоявшихся наследственных изменений, как правило, имеющих адаптивную (приспособительную) ценность, выражается и в особенностях созревания яйцеклеток. Мейоз начинается в яичниках девочек на третьем месяце внутриутробного развития, когда с момента оплодотворения прошло не так много митотических делений и еще не успели накопиться мутации. До седьмого месяца делящиеся клетки находятся в стадии лептотены и зиготены. От седьмого месяца до рождения успевают пройти пахитены и диплотены, затем мейоз останавливается, образуются кариолемма и ядрышко. Эта особая стадия – диктиотена – продолжается до первой овуляции. При рождении у девочки имеется около 2,6 х 106 ооцитов, из которых большинство (около 90%) дегенерирует. За всю жизнь женщины только около 400 ооцитов созревают полностью. В яичнике каждый ооцит окружен слоем эпителиальных клеток и двумя слоями соединительной ткани – эта структура называется фолликул. В постпубертантный период (в среднем с 12 лет) в первой половине цикла под действием лютеинизирующего гормона начинается диакинез. В ходе редукционного деления образуется первое полярное тельце. Первое полярное тельце, как правило, позднее проходит эквационное деление. Далее мейоз проходит до метафазы II и останавливается до встречи яйцеклетки со сперматозоидом в фаллопиевой трубе. Проникновение сперматозоида стимулирует расхождение хроматид, формирование ядерной мембраны, женского пронуклеуса и второго полярного тельца. Из хроматина сперматозоида образуется мужской пронуклеус, который через несколько часов сливается с женским пронуклеусом, образуя зиготу – оплодотворенную яйцеклетку. Путем дробления зиготы образуется эмбрион.
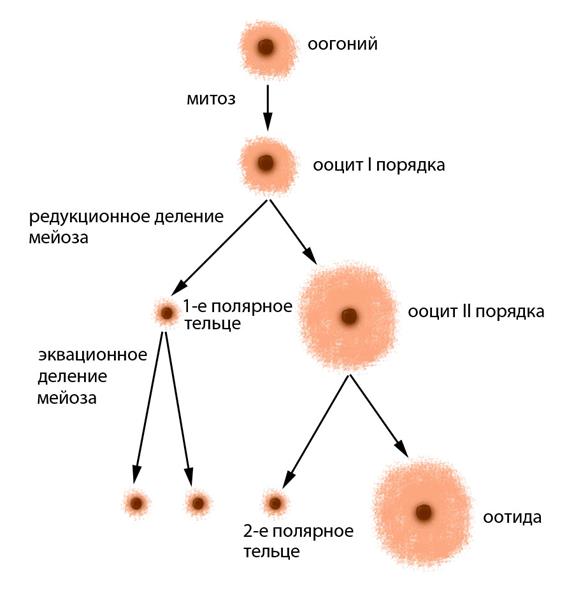
Рисунок V , 6. Оогенез человека. Оогонии – предшественники ооцитов, способные к митотическому делению. Ооциты I порядка – диплоидные продукты митотического деления оогониев. Ооциты II порядка – гаплоидные продукты редукционного деления ооцитов I порядка. Оотида – крупная яйцеклетка, возникшая при эквационном делении ооцита II порядка.
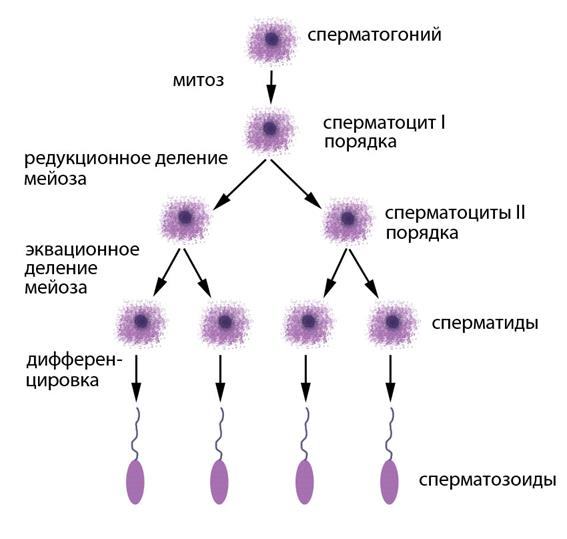
Рисунок V , 7. Сперматогенез человека. Сперматогонии – предшественники сперматоцитов, способные к митотическому делению. Сперматоциты I порядка – диплоидные продукты митотического деления сперматогониев. Сперматоциты II порядка – гаплоидные продукты редукционного деления сперматоцитов I порядка. Сперматиды – гаплоидные продукты эквационного деления сперматоцитов II порядка.
5.3 Структурно-функциональная организация хромосом.
Хроматин — это вещество, из которого состоят хромосомы эукариотических клеток, представляющее собой комплекс ДНК, РНК и белков. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК.
Основную массу хроматина составляют белки гистоны, котрые ответственны не только за укладку ДНК, но выполняют и регуляторную функцию. Гистоны H2A, H2B, H3 и H4 образуют нуклеосомы — особые структуры шайбовидной формы высотой 6 нанометров и 11 нанометров в диаметре, участвующие в самом первом этапе упаковки ДНК в хромосомы (Рисунок V, 8). В состав каждой нуклеосомы входит по две молекулы каждого из указанных видов гистонов (всего восемь молекул, такие комплексы называют октамерами). Из-за того, что нуклеосомы располагаются более или менее регулярно, образующаяся структура напоминает бусы (Рисунок V, 9). Наиболее крупный из всех гистонов – гистон H1- связывается с ДНК на участке между нуклеосомами (Рисунок V, 8). Компактизация и декомпактизация хроматина на уровне нуклеонемы (нуклеосомной нити) регулируется гистоном H1. При репликации – удвоении нити ДНК – нуклеосомы не распадаются, а переходят на одну из дочерних нитей случайным образом. Недостающие октамеры синтезируются заново. Самый первый уровень укладки хромосом – нуклеонемный – обеспечивает компактизацию ДНК в 6-7 раз.
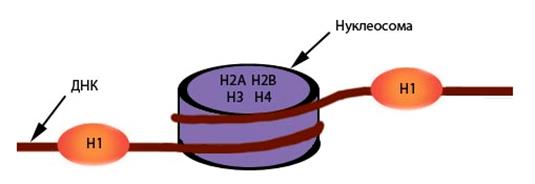
Рисунок V, 8. Схема нуклеосомной организации хроматина. Взаимное пространственное расположение гистонов H2A, H2B, H3 и H4 не отражено.

Рисунок V, 9. Нуклеосомная нить - нуклеонема.
Нить ДНК с нуклеосомами образует структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу (Рисунок V, 10). Ее можно увидеть на препаратах выделенного хроматина. Удаление даже некоторой части молекул гистона H1 приводит к распадению фибриллы до толщины 10 нанометров, что соответствует примерной толщине нуклеосомы. Это свидетельствует о том, что гистон H1 играет ключевую роль во взаимодействии между нуклеосомами. На уровне фибриллы 30 нанометров достигается примерно сорокакратная компактизация ДНК. На таком уровне спирализации существенно снижается способность ДНК связываться с белками, участвующими в транскрипции, что приводит к уменьшению генетической активности упакованных в фибриллу 30 нанометров участков.
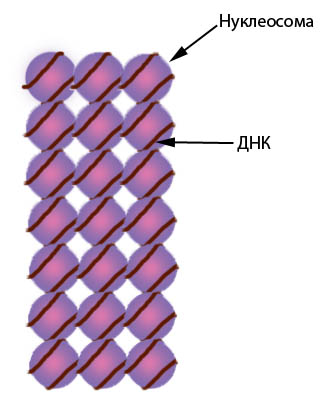
Рисунок V, 10. Фибрилла толщиной 30 нанометров.
Около 20% всех белков хроматина составляют негистоновые белки. Именно они имеют значение для более высоких уровней компактизации хроматина. Выявляемые на препаратах клеточного ядра шарики диаметром 100 нанометров (хромомеры) имеют петлевую розетковидную структуру (Рисунок V, 11). Это третий уровень компактизации. Он обеспечивает примерно 600-700-кратное укорочение ДНК.

Рисунок V, 11. Петлевой домен. А - структура в виде розетки. Б - хромонема.
На препаратах митотических хромосом иногда можно увидеть спираль, образованную нитчатой хроматиновой структурой толщиной около 200 нанометров – хромонемой (Рисунки V, 11 и V, 12). Это четвертый уровень укладки хроматина. Витки хромонемы образуют хроматиду толщиной примерно 500 нанометров, что обеспечивает укорочение ДНК примерно в 104 раз.

Рисунок V, 12. Хромонемная организация митотической хромосомы.
5.4 Дифференциальное окрашивание и блочная организация хромосом
При окрашивании митотических хромосом ацидофильными (то есть связывающимися с кислотами) красителями, например эозином, или неспецифическими к нуклеотидам флуоресцентными красителями (флуорохромами – веществами, способными излучать световые волны большей длины при возбуждении светом с меньшей длиной волны) выявляется практически равномерный рисунок без исчерченности. Такая окраска называется рутинной (Рисунок V, 13).

Рисунок V, 13. Митотические хромосомы человека, окрашенные рутинно, краситель Романовского-Гимзы – раствор эозина и метиленового синего (по материалам сайта http://131.229.114.77/microscopy/galllm.html).
Если перед окрашиванием митотические хромосомы обработать щелочными растворами, вымывающими ДНК в первую очередь из районов с низкой плотностью хроматина, можно наблюдать интенсивное окрашивание прицентромерных районов всех хромосом и практически полное интенсивное окрашивание Y-хромосомы (Рисунок V, 14). Такой подход называется C-методом дифференциального окрашивания хромосом или C-бендингом. C-положительные (интенсивно окрашенные при использовании этого метода) районы хромосом соответствуют участкам генетически инертного хроматина – или гетерохроматина. Различная степень окрашивания районов хромосом при C-окраске говорит о неоднородности распределения гетерохроматина по длине хромосом.
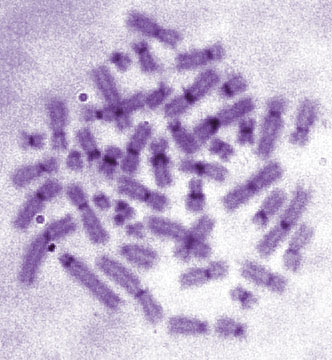
Рисунок V, 14. Митотические хромосомы человека, окрашенные по C-методу. Фотография Е.Г. Нероновой.
В зависимости от степени плотности упаковки фибриллы 30 нанометров различают более конденсированный хроматин – гетерохроматин - и менее конденсированный эухроматин. Гетерохроматиновые участки очень интенсивно окрашиваются при дифференциальной C-окраске хромосом из-за большей плотности и хорошо видны под микроскопом. ДНК, находящаяся в гетерохроматине, не транскрибируется и содержит большое количество повторяющихся последовательностей. На стадии интерфазы гетерохроматин часто располагается по периферии ядра (пристеночный гетерохроматин). В эухроматине ДНК упакована сравнительно неплотно. Гены, находящиеся в эухроматиновых районах, активно транскрибируются. Плотность упаковки хроматина зависит от модификаций гистонов (метилирования, ацетилирования, фосфорилирования), в первую очередь это относится к гистону H1. Гетерохроматин у млекопитающих состоит преимущественно из АТ (аденин-тимин)-обогащенной высокоповторяющейся ДНК. Таким образом, C-окраска позволяет выявлять наиболее различающиеся по своему составу и плотности районы хромосом.
Если обработки перед окрашиванием проводить более мягко, можно обнаружить поперечную исчерченность митотических хромосом. Это дифференциальная G-окраска или G-бендинг (Рисунок V, 15). G-положительные районы соответствуют более компактизованным, менее насыщенным генами участкам хромосом, которые содержат количество АТ-пар большее, чем G-отрицательные районы. Как правило, в G-положительных районах (G+-блоках) находятся тканеспецифические и стадиеспецифические гены, транскрипция которых нужна не во всех клетках. В этом заключается биологическое значение блочной организации хромосом – гены, которые одинаково нужны во всех клетках, находятся в более деконденсированных участках хромосом, где ДНК более доступна для ферментов транскрипции. Для получения отчетливой G-окраски обычно используют мягкую обработку хромосом раствором трипсина с последующим окрашиванием красителем Романовского-Гимзы. По общепринятой трехбуквенной номенклатуре, которая часто используется в записи цитогенетического диагноза, такая окраска обозначается GTG (G-окраска – трипсин – Гимза).
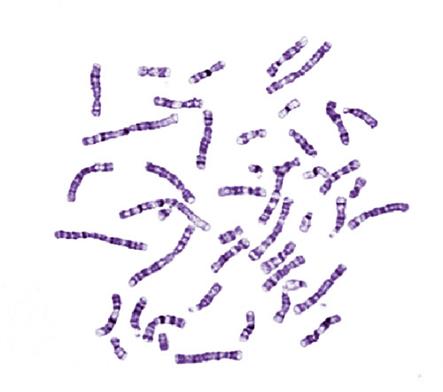
Рисунок V, 15. Митотические хромосомы человека, окрашенные по GTG-методу. По материалам сайта http://www.subtelomeres.com/ClinicalDiagnosis_6.html.
G+-блоки также могут быть выявлены при окрашивании хромосом АТ-специфическими флуорохромами (DAPI, Хехст 33258) – это дифференциальная Q-окраска или Q-бендинг (Рисунок V, 16). АТ-богатые G-положительные районы связывают большее количество красителя, что приводит к их более интенсивной флуоресценции. Использование этого метода позволяет идентифицировать Y-хромосому даже в интерфазе, поскольку значительная ее часть состоит из необычайно АТ-богатого гетерохроматина, который при связывании с флуорохромами дает бриллиантовое свечение.
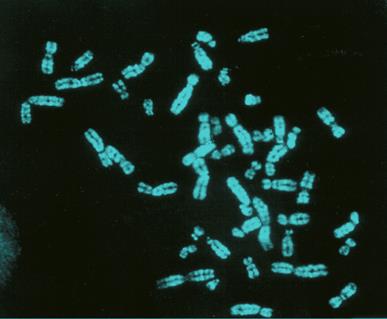
Рисунок V, 16. Митотические хромосомы человека, окрашенные по Q-методу. По материалам сайта http://www.translational-medicine.com/content/3/1/21/figure/F4?highres=y.
Рисунок обратный G-бендингу получается при помощи R-метода дифференциального окрашивания путем тепловой денатурации (Рисунок V, 17). ГЦ-пары, которых больше в G-отрицательных районах хромосом, более устойчивы к этой процедуре. Подавляющее большинство G+-районов соответствует R- и наоборот (Рисунок V, 18). Само название этого метода происходит от английского слова reversed – обратный. R+-районы реплицируются в первой половине фазы S клеточного цикла, а G+-районы - во второй. Существуют методики выявления R-бендинга путем введения в клетки модифицированных предшественников синтеза ДНК в середине фазы S. Тогда R+-районы не будут содержать модифицированных нуклеотидов, а G+-районы – будут.
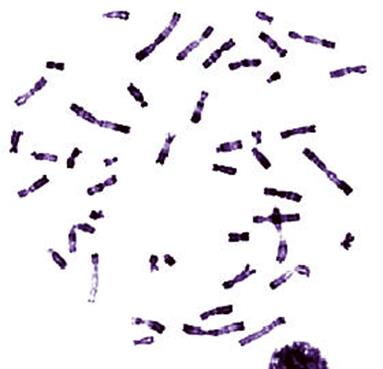
Рисунок V, 17. Митотические хромосомы человека, окрашенные по R-методу. По материалам сайта http://www.currentprotocols.com/protocol/hg0402.
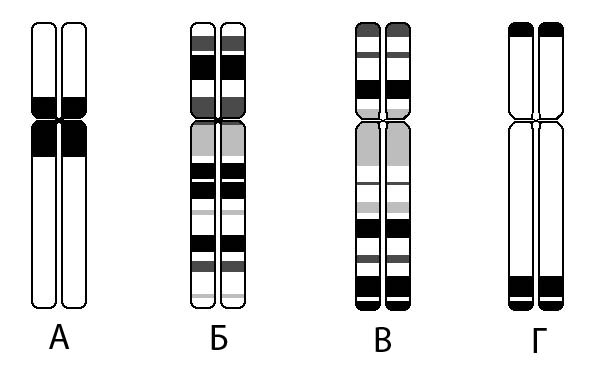
Рисунок V, 18. Схематическое изображение одной и той же митотической хромосомы, окрашенной при помощи различных методов дифференциального окрашивания. А - C-метод, Б - G-метод, В - R-метод, Г - T-метод.
При более интенсивной тепловой обработке выявляются T-сегменты, расположенные преимущественно в прителомерных районах хромосом (Рисунок V, 19). Их локализация совпадает с наиболее близкими к теломере R-сегментами (Рисунок V, 18). Содержание генов в T+-районах на порядок больше, чем в среднем по длине хромосомы, и больше чем в относительно обогащенных генами R+-районах. Некоторые функциональные особенности позволяют считать T-сегменты наиболее выраженными R-сегментами. В таких районах находится особенно много генов, связанных с наиболее важными функциями жизнеобеспечения клетки – генов домашнего хозяйства – и онкогенов, мутация которых может привести к злокачественной опухоли. Это определяет особое значение теломерных районов в онкогенезе.

Рисунок V, 19. Митотические хромосомы человека, окрашенные по T-методу – флуоресцентный вариант гибридизации с использованием Alu-специфических ДНК-зондов (глава VIII). По материалам сайта http://www.statemaster.com/encyclopedia/Image:PLoSBiol3.5.Fig7ChromosomesAluFish.jpg
Районы ядрышковых организаторов (ЯОР), содержащих гены рибосомной РНК и формирующих в интерфазе ядрышки, могут быть выявлены при помощи окраски нитратом серебра (AgNO3). Такой тип окраски называется N-бэндинг.
Для обозначения хромосомы человека используется аббревиатура HSA (от латинского видового названия Homo sapiens) и цифра, соответствующая номеру хромосомы. Например, HSA21 – хромосома 21 человека. В клинической практике обозначение HSA иногда опускают, поскольку ясно, что речь идет о человеке. Для удобства определения отдельных районов хромосом их обозначают числами как показано на рисунке V, 20. Последняя цифра числового обозначения указывает на определенный бэнд – полоску, выявляемую при дифференциальном окрашивании, первая цифра указывает на условную часть хромосомы, состоящую из нескольких бэндов. По умолчанию приводят обозначения сегментов, выявляемых G-методом. Теломеры обозначаются ter. Длинное и короткое плечи обозначаются q и p, соответственно.
Примеры:
HSA14p11 – район 11 короткого плеча хромосомы 14 человека
HSAXqter – теломер длинного плеча Х-хромосомы человека
5pter-p11 – участок, ограниченный теломером и бендом 11 короткого плеча хромосомы 5 (включает 5p11, 5p12, 5p13, 5p14, 5p15.1, 5p15.2 и 5p15.3) (Рисунок V, 20).
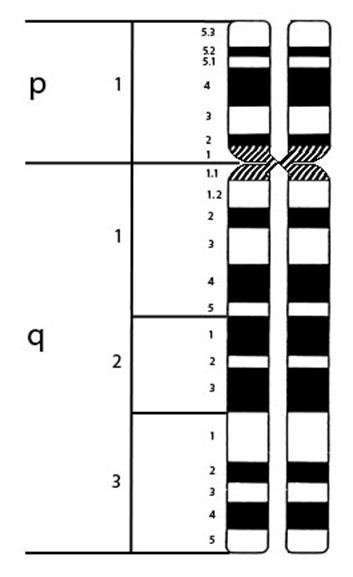
Рисунок V, 20. Схема обозначения районов хромосом на примере хромосомы 5 человека (HSA5), дифференциально окрашенной по G-методу (уровень разрешения 400 сегментов на кариотип).
Для повышения точности цитогенетического анализа часто используют прометафазные и даже профазные хромосомы, что позволяет увеличить число распознаваемых сегментов дифференциального окрашивания до 850 и 1700, соответственно.
5.5 Гибридизация in situ , хромосомный пейнтинг и сравнительная геномная гибридизация ( CGH )
ДНК имеет двунитевую структуру. Это дает возможность провести плавление (денатурацию), то есть перевести ДНК в однонитевую форму, затем восстановить двунитевую структуру по принципу комплиментарности с использованием однонитевой молекулы ДНК-зонда - иными словами провести гибридизацию двух молекул ДНК. Если молекула ДНК-зонда содержит меченые нуклеотиды, ее можно выявить при помощи одной из систем детекции гибридизационного сигнала. Гибридизация нуклеиновых кислот in situ (от лат. in situ – на месте) подразумевает проведение процедуры непосредственно на цитологическом препарате хромосом, интерфазных ядер или цитоплазмы.
Изначально метод гибридизации in situ применялся только для локализации повторяющихся последовательностей, сгруппированных в одном или нескольких районах митотических хромосом, благодаря чему они образуют относительно крупный участок связывания (мишень) для молекул зонда.
В 80-е годы XX столетия стали появляться сообщения о применении метода гибридизации in situ для локализации уникальных последовательностей на митотических хромосомах с использованием статистического анализа.
Выявление уникальных последовательностей ДНК в митотических хромосомах требует соблюдения трех условий. Во-первых, зонды должны быть надежными: четко охарактеризованными и чистыми. Во-вторых, необходимы специальные приемы, облегчающие связывание молекул зонда и мишени в хромосомах. В-третьих, неспецифическое связывание ДНК-зонда с цитологическим материалом должно быть сведено к абсолютному минимуму. Выполнение первого условия в настоящее время практически не вызывает затруднений, поскольку для получения ДНК-зондов можно использовать технологию генной инженерии. Второе условие также выполнимо благодаря использованию декстран сульфата - агента, эффективно повышающего (примерно в 10 раз) скорость ренатурации одноцепочечных молекул ДНК в растворе. Это способствует образованию протяженных сотовидных конгломератов одноцепочечных молекул ДНК, связанных между собой за счет случайно расположенных двухцепочечных участков.
Использование в качестве метки радиоактивных изотопов позволяет эффективно локализовать даже небольшие фрагменты ДНК – порядка 1-2 т.п.н. Основными недостатками изотопного варианта гибридизации являются относительно низкая разрешающая способность, необходимость длительной процедуры авторадиографии и технические и сложности, связанные с хранением и использованием радиоактивных веществ.
Негативные аспекты использования радиоактивной метки служили стимулом для попыток разработать эквивалентные по эффективности, но более безопасные, быстрые и дешевые методы. В результате были разработаны методы гибридизации с использованием нерадиоактивно меченых зондов, выявляемых посредством различных иммунохимических методов. Было установлено, что новая технология гибридизации обладает рядом преимуществ, к которым относится ее полная безопасность для исследователя. Другим положительным свойством нерадиоактивно меченых зондов является их химическая устойчивость в течение нескольких месяцев. Применение нерадиоактивных меток обеспечивает более высокую разрешающую способность, чем работа с изотопами, а в ряде случаев повышает уровень информативности. Неизотопная гибридизация позволяет картировать (то есть определять местоположение на хромосоме) уникальные гены размером около 1 т.п.н. Наконец, результаты гибридизации можно анализировать сразу после проведения эксперимента. Таким образом, преимущества нерадиоактивного мечения зондов заключаются в высокой разрешающей способности, точности, воспроизводимости, дешевизне и безопасности.
Чувствительность данного метода зависит от размера гена, количества его копий, специфической активности зонда, а также от количества молекул флуорохрома, присутствующих в гибриде на заключительной стадии эксперимента.
Неизотопный вариант гибридизации in situ позволяет использовать несколько ДНК-зондов, меченных разными агентами, на одном цитологическом препарате (многоцветная гибридизация). Такой подход используют для тонкого интерфазного картирования с разрешающей способностью до 100 т.п.н.
Повышению специфичности метода служит супрессия (подавление) неспецифической гибридизации путем добавления в гибридизационную смесь небольшого количества конкурирующей ДНК. Такая процедура необходима при использовании в качестве зондов больших геномных последовательностей ДНК.
В настоящее время наиболее часто используется метод биотинового мечения. Его принцип основан на сильном взаимодействии биотина с белком авидином вследствие их высокого сродства. Молекула авидина потенциально может образовать 4 химические связи, поэтому после связывания его с биотином три связи остаются свободными, что используется при детекции сигнала гибридизации.
Приготовление хромосомных препаратов производится согласно существующим методикам. На следующем этапе метафазные хромосомы подвергаются обработке РНК-азой с целью удаления связанной РНК. Далее ДНК зондов и хромосом денатурируют, создавая одноцепочечные структуры. Хромосомные препараты инкубируют с зондом в течение определенного времени. Затем удаляют избыток меченой ДНК, не связавшейся с денатурированной ДНК хромосом, посредством специальной отмывки препаратов. Последним этапом эксперимента является детекция сайтов гибридизации. Суть его сводится к следующему: ДНК, содержащая в своем составе биотин, легко распознаваема при контакте ее с авидином (стрептавидином). Последний, в свою очередь, может быть выявлен флуоресцентно. Такой подход в наше время является наиболее распространенным и называется флуоресцентная гибридизация in situ (FISH – fluorescent in situ hybridization) (Рисунок V, 21).
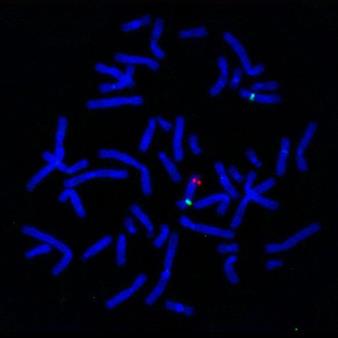
Рисунок V, 21. Двуцветный вариант флуоресцентной гибридизации in situ. По материалам сайта http://qwickstep.comsearchchromosome-12.html.
В последние годы для картирования геномов высших эукариотов используют протяженные ДНК-зонды величиной 10 - 150 т.п.н., которые, как правило, клонируют в космидах (см. глава VI) или в искусственных хромосомах дрожжей или бактерий. Применение перекрывающихся протяженных ДНК-клонов (контигов) позволяет связать хромосомный и молекулярный уровни картирования геномов.
Для выявления тонких хромосомных перестроек и для быстрой идентификации хромосом применяют метод хромосомного пэйнтинга - в этом случае в качестве зонда для гибридизации используют последовательности из хромосомоспецифических библиотек. Одновременно можно использовать несколько хромосомоспецифических зондов и получить изображение, где каждая хромосома представлена своим цветом (Рисунок V, 22). Присутствие фрагментов другого цвета на хромосоме будет говорить о хромосомной перестройке.
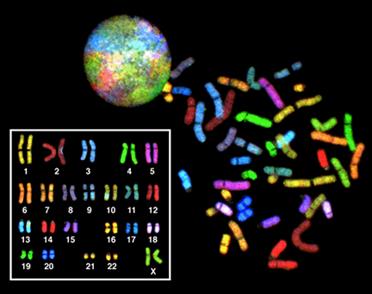
Рисунок V, 22. Хромосомный пейнтинг (мультиFISH или спектральный анализ кариотипа). По материалам сайта http://people.musc.edu~hazardsWebBioInformaticsSKY_CGH.htm.
В последние годы для выявления тонких хромосомных перестроек, размер которых может лежать за пределом разрешающей способности микроскопа, используют метод сравнительной геномной гибридизации (CGH – comparative genomic hybridization). Суть метода заключается в количественной оценке ДНК, связывающейся с молекулой короткого зонда на биочипе (Рисунок V, 23). Все хромосомы и отдельные районы представлены специфическими только для них ДНК-зондами, закрепленными на стекле. Координаты каждой такой последовательности введены в специальную программу. ДНК от анализируемого индивидуума и контрольный образец метят разными флуорохромами и гибридизуют на биочипе. После отмывок сканер считывает уровень флуоресценции в отдельных точках на биочипе. Этот уровень прямо пропорционален количеству связавшейся ДНК с определенным зондом, локализация которого известна. Снижение вдвое уровня флуоресценции в местах расположения зондов из определенного района по сравнению с нормальной клеткой свидетельствует о гетерозиготности по делеции (утрате) данного района. У гомозигот по делеции флуоресценция зондов из делетированных районов отсутствует вовсе. У гетерозигот по дупликации (удвоению хромосомного района) флуоресценция зондов из дуплицированного района в полтора раза выше, чем у кариотипически нормальных индивидуумов.
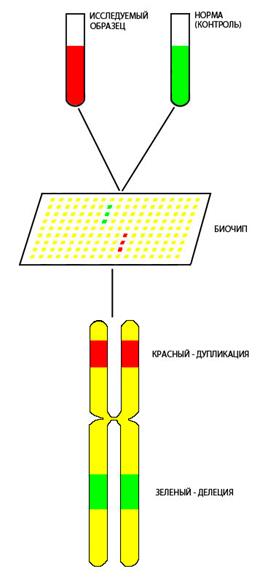
Рисунок V, 23. Схема метода сравнительной геномной гибридизации (CGH).
5.6 Теория старения в связи с динамикой структуры теломеры
Теломеры — это концевые участки хромосом (Рисунок V, 1). Теломерные участки хромосом выполняют защитную функцию, они не способны соединяться с другими хромосомами или их фрагментами.
У большинства эукариот теломерные последовательности ДНК представляет собой короткие тандемные повторы (повторы одинаково ориентированных единиц). В теломерных участках хромосом ДНК вместе с белками, специфически связывающимися с теломерными повторами, образует нуклеопротеидный комплекс — конститутивный (структурный) теломерный гетерохроматин. Теломерные повторы — весьма консервативные последовательности. У всех позвоночных, в том числе у человека, они представляют собой многократные повторы шести нуклеотидов - ТТАГГГ.
Из-за того, что ДНК-полимераза не способна синтезировать линейную молекулу ДНК до самого конца, с каждым циклом деления теломеры клетки укорачиваются. Данный феномен называется концевой недорепликацией и считается одним из важнейших факторов биологического старения. Однако, вследствие этого явления теломеры должны укорачиваться очень медленно - по 3-6 нуклеотидов за один акт репликации. Известно ограничение числа делений одной дифференцированной клетки - предел Хейфлика, которое у человека равно 52. Таким образом, за это число делений теломеры могут стать короче всего на 156-312 нуклеотидов, что совершенно не существенно, учитывая многократное повторение теломерной последовательности ТТАГГГ. Существует эпигенетическая теория старения, согласно которой постепенная утрата маркеров репрессии (подавления) неактивного хроматина приводит к активации перемещения мобильных элементов. Клетка запускает механизмы удаления вызванных этими перемещениями повреждений, что приводит к укорочению теломер в десятки и сотни раз.
В стволовых и половых клетках активно работает особый фермент — теломераза, который при помощи собственной РНК-матрицы достраивает теломерные повторы и удлиняет теломеры. Однако в большинстве дифференцированных клеток теломераза заблокирована, что приводит к неминуемому укорочении теломер и повышению вероятности мутаций расположенных в T-дисках онкогенов и генов домашнего хозяйства.
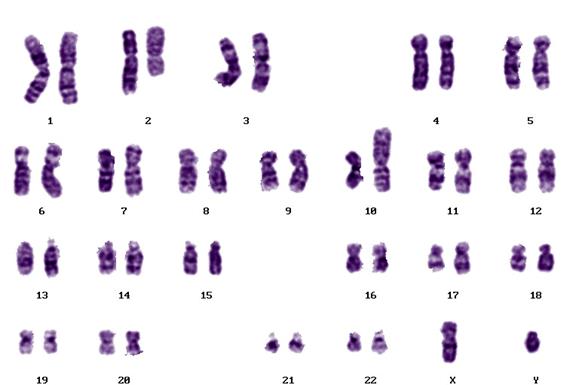
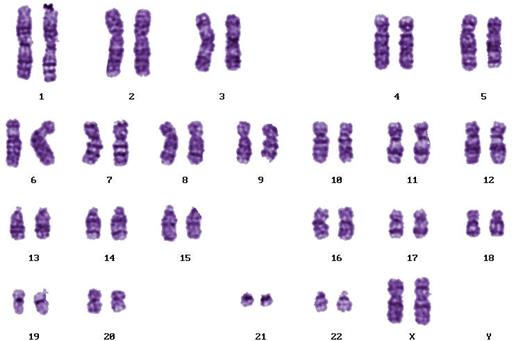
5.7 Нормальный кариотип человека
Кариотип человека в норме состоит из 23-х пар хромосом, которые располагают под номерами в порядке убывания их линейных размеров (Рисунок V, 24). Аутосомы (все хромосомы кроме половых) образуют одинаковый набор у обоих полов. Мужской набор половых хромосом XY, женский - XX. Кариотип нормального мужчины – 46, XY, нормальной женщины 46, XX. Как и у всех млекопитающих, гетерогаметным полом у человека является мужской. Y-хромосома состоит преимущественно из гетерохроматина. Небольшая по длине эухроматиновая часть содержит 397 генов (при общем числе генов у человека более 25000 для одной из самых коротких хромосом это немало). Для компенсации дозы генов в клетках женского организма происходит инактивация одной из X-хромосом. X-хромосома содержит 1606 генов. Примечательно, что в ней остается небольшая неинактивированная часть, содержащая примерно четверть генов, что уравнивает дозу работающих генов у обоих полов (примерно 400 генов половых хромосом представлено двумя копиями).
Хромосомы человека принято условно подразделять на восемь групп, которые обозначают латинскими буквами от A до G. Такое подразделение вызвано тем, что не всегда можно точно определить номер хромосомы. Распределение хромосом по группам было выполнено на основании их морфологических особенностей, видимых при рутинном окрашивании.

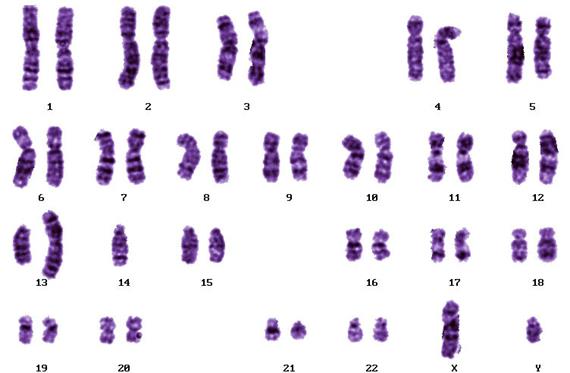
Рисунок V , 24. Нормальная метафазная пластинка (А) и раскладка (Б) дифференциально окрашенных по G-методу хромосом человека. По материалам сайта http://homepage.mac.com/wildlifeweb/cyto/human/index.html.
Группа А включает хромосомы 1, 2 и 3 – это метацентрические и субметацентрические хромосомы. Хромосома 1 – самый большой метацентрик в кариотипе. Хромосома 2 является самой крупной субметацентрической хромосомой. Метацентрическая хромосома 3 отличается примерно на 1/5 по длине от хромосомы 1 и, поэтому, легко может быть идентифицирована. В проксимальном (находящемся ближе к центромере) районе длинного плеча хромосомы 3 при использовании Q-окраски выявляется очень яркий сегмент, который также позволяет безошибочно определить эту хромосому.
Группа B включает хромосомы 4 и 5 – крупные субметацентрики. Отличить их друг от друга при рутинном окрашивании невозможно.
Группа C представлена хромосомами 6-12. В эту же группу входит половая X-хромосома. Все хромосомы этой группы - метацентрики среднего размера. Индивидуально различить их можно только при помощи G-, R- или Q-окраски.
Группа D включает три пары акроцентрических хромосом средней длины – с 13 по 15. Все они содержат вторичную перетяжку – место локализации ЯОР (ядрышкообразующих районов), отделяющую небольшой по длине спутник от остальной части короткого плеча. Размеры спутников заметно варьируют у разных индивидуумов. Иногда наблюдаются два спутника.
К группе E относят короткие метацентрические и субметацентрические хромосомы с 16 по 18. Хромосома 16 – метацентрик, ее длина составляет около трети от длины хромосомы 1. Хромосомы 17 и 18 близки по центромерному индексу (около 0,30) и несколько (5-10%) различаются по длине.
Группа F объединяет две маленькие метацентрические хромосомы 19 и 20, практически неразличимые без дифференциальной окраски.
Группа G включает маленькие акроцентрические хромосомы 21 и 22. К этой группе относят и половую Y-хромосому, которая отличается от других хромосом этой группы положением хроматид длинного плеча – у Y-хромосомы они расположены близко, а у хромосом 21 и 22 – широко расставлены. Размер Y-хромосомы варьирует в широких пределах за счет изменения размеров гетерохроматинового блока, не оказывающего существенного влияния на фенотип. Такая вариабельность видна даже в интерфазных ядрах при окрашивании АТ-специфическими флуорохромами. В коротких плечах хромосом 21 и 22 обнаруживается вторичная перетяжка – подобно хромосомам группы D они содержат ЯОРы. Рисунки дифференциальной исчерченности хромосом 21 и 22 существенно различаются, что позволяет проводить их индивидуальную идентификацию.
5.8 Аномалии числа хромосом
Мутации - наследуемые изменения генетического аппарата. Обычно их подразделяют на геномные, хромосомные и генные. В двух последних случаях изменения происходят внутри хромосом или внутри отдельных генов соответственно. Под геномными мутациями понимают изменения числа хромосом. Если изменение кратно гаплоидному числу хромосом (у человека - 23), то такие геномные мутации относят к полиплоидиям, если изменение не кратно гаплоидному числу хромосом (например, одна дополнительная или одна недостающая хромосома) – к анеуплоидиям.
Согласно общепринятой международной номенклатуре кариотип принято записывать следующим образом: вначале записывают общее число хромосом, затем – половые хромосомы. При нормальном кариотипе этим и ограничиваются, при наличии хромосомных нарушений их описывают при помощи специальных обозначений, которые будут рассмотрены при изложении материала о каждой из них.
Пример:
46, ХХ – нормальная женщина;
46, XY – нормальный мужчина.
Если не все клетки организма имеют одинаковый кариотип, то такие организмы называют мозаичными или мозаиками. Обычно фенотипическое проявление наблюдается у мозаиков, если мутантных клеток больше четверти. На этом наблюдении основан широко распространенный в диагностической практике метод анализа хромосом. На первом этапе анализируют 11 метафазных пластинок – это число соответствует рассчитанному числу клеток, где при 25%-ном мозаицизме статистически достоверно присутствует более одной мутантной клетки. Если мутантных клеток не обнаружено, то индивидуума считают кариотипически нормальным. Если среди 11-ти проанализированных клеток две и более окажутся мутантными – диагностируется мозаицизм. Если только одна клетка окажется мутантной – анализируют еще 6 клеток. Если среди них не находят ни одной мутантной (причем именно с такой мутацией как и у первой выявленной мутантной клетки) – индивидуум считается кариотипически нормальным, а обнаружение первой мутантной клетки считают случайным. Если среди проанализированных 6-ти клеток находят еще одну мутантную с той же мутацией, то в анализ берут еще 6 клеток. Анализ продолжают до тех пор, пока не обнаружат две или более мутантных клетки среди очередной проанализированной серии. Тогда ставят диагноз - мозаицизм. Если в очередной серии проанализированных клеток все они будут иметь нормальный кариотип - индивидуума считают кариотипически нормальным.
Из всех возможных вариантов полиплоидов у человека описаны только триплоиды – обычно это выкидыши на разных стадиях внутриутробного развития. Иногда живорожденные дети-триплоиды смогли прожить несколько часов или дней, причем большинство из них были мозаиками. Известны отдельные случаи выживания мозаиков по триплоидии. Фенотипически триплоидия проявляется прежде всего в пузырном перерождении плаценты. Характерные для многих хромосомных аномалий признаки – умственная отсталость, неполное зарастание родничка, локальные пороки развития – наблюдаются и при этом типе геномных мутаций.
Наиболее распространенный случай анеуплоидии – трисомия (наличие одной добавочной хромосомы) по хромосоме 21 или синдром Дауна. Эта аномалия встречается с частотой 1 на 700 новорожденных. Риск рождения ребенка с синдромом Дауна повышается с увеличением возраста матери. В последние годы частота рождения детей с этим синдромом в развитых странах снижается по причине использования пренатальной (дородовой) диагностики. У больных отмечается задержка роста и развития, умственная отсталость, врожденный порок сердца, снижение иммунитета, снижение мышечного тонуса. Внешне их легко узнать – широкое лицо, раскосые глаза с эпикантусом (складкой верхнего века), короткий нос, большой складчатый язык (Рисунок V, 25). Как и для всех хромосомных аномалий человека, для синдрома Дауна характерна высокая изменчивость фенотипических проявлений – у разных индивидуумов может наблюдаться разная выраженность отдельных симптомов, а некоторые из них могут отсутствовать вовсе. Обычно больные миролюбивы, неплохо проходят социальную адаптацию – некоторые даже образуют семьи. Средняя продолжительность жизни – 49 лет. Больные мужчины бесплодны, у некоторых женщин могут быть дети, как с синдромом Дауна, так и нормальные. Запись кариотипа с трисомией по хромосоме 21 выглядит так: 47, ХХ, +21 или 47, ХY, +21. Кроме дополнительной хромосомы 21 причиной этого синдрома могут быть внутрихромосомные перестройки с ее участием.
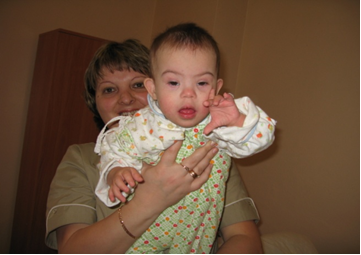
Рисунок V, 25. Ребенок с синдромом Дауна. Фото С.В. Дундуковой.
Другой пример анеуплоидии с множественными пороками развития – трисомия по хромосоме 18 или синдром Эдвардса. Это второе по частоте встречаемости хромосомное заболевание после синдрома Дауна – 1 на 7000. Кариотип больных девочек и мальчиков соответственно 47, ХХ, +18 и 47, XY, +18. Больные рождаются с низким весом (около 2 кг), у них отмечается задержка роста и развития, умственная отсталость, широкие роднички при рождении и открытые швы черепа, грудная клетка шире и короче нормальной, нижняя челюсть и ротовое отверстие маленькие (Рисунок V, 26). Глазные щели узкие и короткие, слуховые отверстия деформированы и иногда отсутствуют. Отмечаются пороки сердца и крупных сосудов, гипоплазия мозжечка и мозолистого тела. До годовалого возраста доживает 5-10%, все выжившие – глубокие олигофрены.
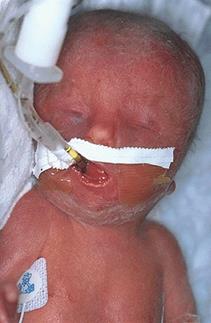
Рисунок V, 26. Ребенок с синдромом Эдвардса. По материалам сайта http://medgen.genetics.utah.edu/photographs/diseases.
Синдром Патау – трисомия по хромосоме 13 в различных популяциях человека встречается с частотами от 1 на 14000 до 1 на 7000, кариотип – 47, +13. Есть связь возраста матери и риска рождения ребенка с этим синдромом, хотя она не такая строгая, как в случае синдрома Дауна. При вынашивании плода с синдромом Патау у половины беременных наблюдается многоводие. Дети рождаются с небольшим весом – около 2,5 кг, имеют умеренную микроцефалию, низкий скошенный лоб, суженные глазные щели, расстояние между которыми уменьшено, помутнение роговицы, микрофтальмию, колобому, расщелину верхней губы и неба, деформированные ушные раковины, полидактилию (Рисунок V, 27). По причине множественных врожденных аномалий большинство больных (до 95%) умирает в возрасте до года. При должном уходе около 15% выживших после достижения годовалого возраста имеют продолжительность жизни 5 лет, 2-3% - 10 лет.
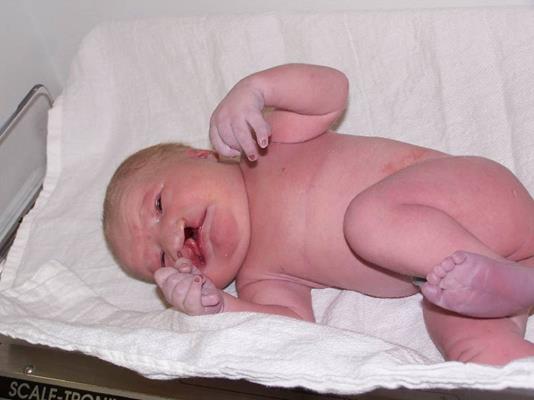
Рисунок V, 27. Ребенок с синдромом Патау. По материалам сайта http://ptgandg.com/peter.htm.
Синдром Варкани – трисомия по хромосоме 8 описан преимущественно у мозаиков 46 / 47, +8. Полная трисомия по хромосоме 8, как правило, летальна. Частота встречаемости среди новорожденных – 1 на 5000. Дети рождаются доношенными, возраст матери не влияет на вероятность рождения ребенка с этим синдромом. Характерны умственная отсталость (97,5% случаев), выступающий лоб, косоглазие, глубоко посаженные глаза, эпикантус, гипертелоризм (увеличенное расстояние между парными органами) глаз и сосков, высокое небо (иногда расщелина), толстые губы, вывернутая нижняя губа, аномалии скелета, аплазия мозолистого тела, пороки мочевой системы, узкий таз, узкие плечи (Рисунок V, 28). Со временем развиваются гидроцефалия, паховая грыжа. Продолжительность жизни – не более 17 лет.

Рисунок V, 28. Ребенок с синдромом Варкани (мозаицизм по трисомии 8). По материалам сайта http://web.coehs.siu.eduGrantsTRISkidsofTRISDateOrder.html
Анеуплоидии по половым хромосомам также достаточно часто встречаются в популяциях человека. Моносомия (отсутствие одной из гомологичных хромосом) по Х-хромосоме или синдром Шерешевского-Тёрнера встречается с частотой 1 на 1500. Кариотип – 45, Х. Пол ребенка с моносомией по Х-хромосоме женский, так как у всех млекопитающих мужской пол определяется наличием Y-хромосомы, а не количеством Х-хромосом. Вынашивание девочек с этим синдромом часто проходит с токсикозом и угрозой выкидыша, а роды бывают преждевременными и патологическими. Во второй половине беременности происходит инволюция (обратное развитие) половых клеток и к моменту рождения у ребенка резко уменьшено количество фолликулов или они вовсе отсутствуют. Следствиями недоразвития гонад являются недостаточность женских гормонов, аменорея (отсутствие менструаций) и бесплодие. Для больных девочек характерен низкий рост, отставание в развитии, широкая бочкообразная грудная клетка, короткая шея, крыловидные складки на боковых поверхностях шеи, деформация локтевых суставов (Рисунок V, 29). Часто встречаются пороки сердца и крупных сосудов, аплазия фаланг пальцев, склонность к ожирению и гипертензия. Молочные железы у большинства больных не развиты, соски расположены низко. Матка недоразвита, вход во влагалище – воронкообразный, малые половые губы, клитор и девственная плева недоразвиты, большие половые губы по виду напоминают мошонку. При этом синдроме проявляются все имеющиеся сцепленные с полом рецессивные мутации.
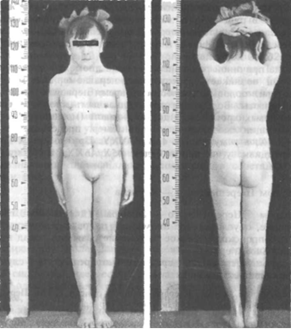
Рисунок V, 29. Шестнадцатилетняя девушка с синдромом Шерешевского-Тёрнера. По материалам сайта http://lekmed.ru/infoarhivyendokrinologiya-56.html.
Синдром тройной Х-хромосомы встречается с частотой 1 на 700. Все больные – внешне нормальные женщины с кариотипом 47, ХХХ. Иногда встречаются две или более дополнительные Х-хромосомы. Умственная отсталость и алалия отмечаются у 75% больных, часто наблюдается недоразвитие фолликулов, ранний климакс и бесплодие.
Одна или несколько дополнительных Х-хромосом у представителей мужского пола – синдром Клайнфельтера. Возможны кариотипы: 47, XXY; 48, XXYY; 48, XXXY; 49, XXXXY; 49, XXXYY). Частота встречаемости 1 на 500-700 новорожденных мальчиков. Для больных характерны высокий рост, длинные конечности при сравнительно коротком туловище, гинекомастия, евнухоидизм, бесплодие, повышенное содержание женских гормонов, ожирение, психические нарушения, склонность к асоциальному поведению (Рисунок V, 30).
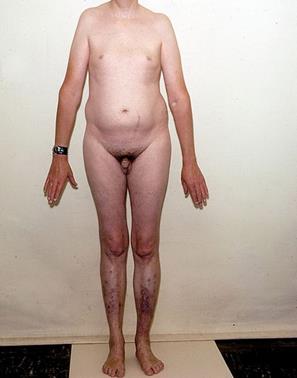
Рисунок V, 30. Мужчина с синдромом Клайнфельтера. По материалам сайта http://dermline.ru/htm/23/233709.htm.
Синдром дополнительной Y -хромосомы (кариотип 47, XYY) встречается с частотой 1 на 500. Клинические проявления практически не выражены. Часто встречаются высокий рост, атлетическое телосложение, несколько повышенный уровень агрессивности, неадекватная реакция на критику, склонность к импульсивным поступкам, любовь к риску и приключениям. Синдром с большей, чем в среднем по популяции, частотой встречается среди осужденных за насильственные преступления, представителей опасных профессий и любителей экстремальных видов спорта.
5.9 Внутрихромосомные перестройки
Кроме аномалий числа хромосом – геномных мутаций – причиной хромосомной патологии могут быть и внутрихромосомные перестройки или аберрации. Их подразделяют на несколько типов:
- делеция – утрата участка хромосомы (обозначается «del») (Рисунок V, 31);
- дефишенси – концевая делеция (обозначается знаком разрыва «:») (Рисунок V, 32);
- дупликация – удвоение участка хромосомы (обозначается «dup») (Рисунок V, 33);
- амплификация – многократное повторение участка хромосомы (обозначается «amp») (Рисунок V, 33);
- инсерция – вставка дополнительного хромосомного района (обозначается «ins») (Рисунок V, 34);
- парацентрическая инверсия – поворот на 180° участка хромосомы, не содержащего центромеру (обозначается «inv») (Рисунок V, 35);
- перицентрическая инверсия – поворот на 180° участка хромосомы, содержащего центромеру (обозначается «inv») (Рисунок V, 36);
- транслокация – перенос участка с одной хромосомы на другую (обозначается t и знаком разрыва-слияния «::») (Рисунок V, 37);
- реципрокная транслокация – обмен участками между негомологичными хромосомами (обозначается «rcp») (Рисунок V, 38);
- робертсоновская транслокация – слияние двух акроцентрических хромосом с образованием одной (суб)метацентрической (Рисунок V, 39). Механизм, как правило, такой: происходит обмен плечами между двумя акроцентрическими хромосомами, приводящий к появлению двух (суб)метацентрических хромосом – состоящих только из длинных плеч вовлеченных в обмен акроцентриков и только коротких. Поскольку хромосома, составленная из коротких плеч исчезает в ходе первых же после возникновения перестройки клеточных делений, единственным результатом робертсоновской транслокации является появление новой (суб)метацентрической хромосомы. Обозначается «rob».
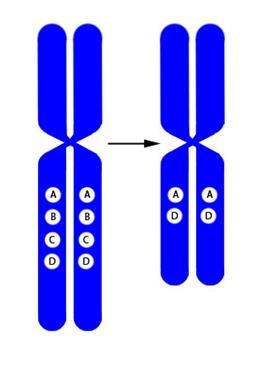
Рисунок V, 31 . Схема делеции.

Рисунок V, 3 2 . Схема дефишенси.
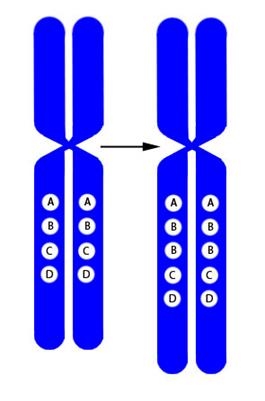
Рисунок V, 3 3 . Схема дупликации.
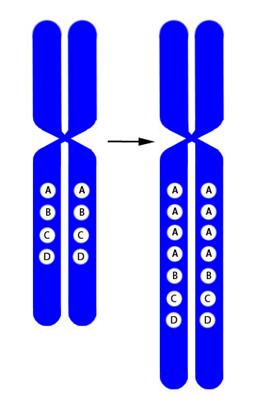
Рисунок V, 3 4 . Схема амплификации.

Рисунок V, 3 5 . Схема инсерции.

Рисунок V, 36. Схема парацентрической инверсии.
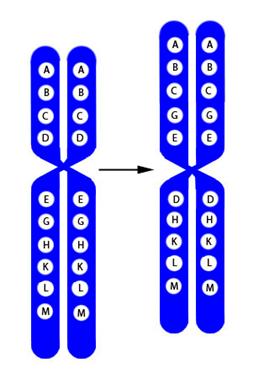
Рисунок V, 37. Схема перицентрической инверсии.
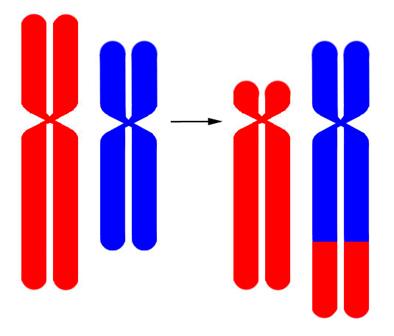
Рисунок V, 3 8 . Схема транслокации.
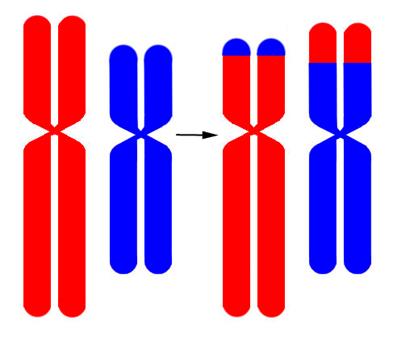
Рисунок V, 39. Схема реципрокной транслокации.
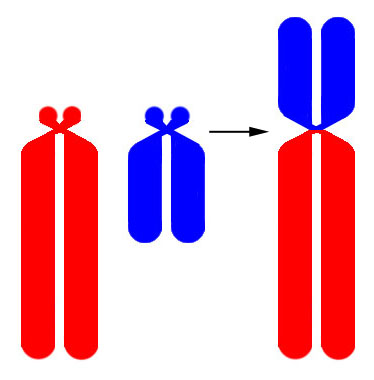
Рисунок V, 40. Схема робертсоновской транслокации.
Примеры:
46, XY, del (10) (q11 → q21) – мужской кариотип с делецией района 10q11-21.
46, XX, del 5p- - женский кариотип с делецией короткого плеча хромосомы 5.
inv 9 (p11; q13) – перицентрическая инверсия в хромосоме 9.
inv 5 (q21; q31) – парацентрическая инверсия в хромосоме 5.
5q33: - дефишенси длинного плеча хромосомы 5, разрыв расположен в районе 5q33.
t (2; 5) (q21; q31) – реципрокная транслокация хромосом 2 и 5. Разрывы и воссоединения произошли в районах 2q21 и 5q31. Эту же транслокацию можно записать более подробно:
t (2; 5) (2pter → 2q21 :: 5q31 → 5qter; 5pter → 5q31 :: 2q21 → 2qter).
Иногда при цитогенетическом обследовании выявляются изохромосомы, состоящие из одинаковых плеч – только коротких или только длинных (Рисунок V, 41). Такая аберрантная хромосома обозначается i.
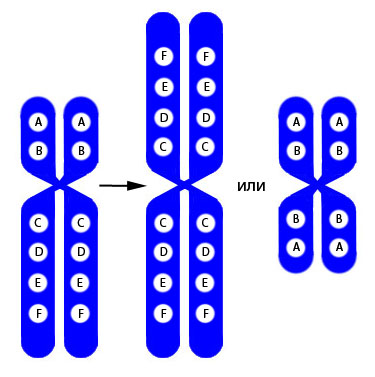
Рисунок V, 41. Схема изохромосомы.
Делеции концевых районов обоих плеч иногда приводят к формированию кольцевой хромосомы (обозначается r) (Рисунок V, 42).
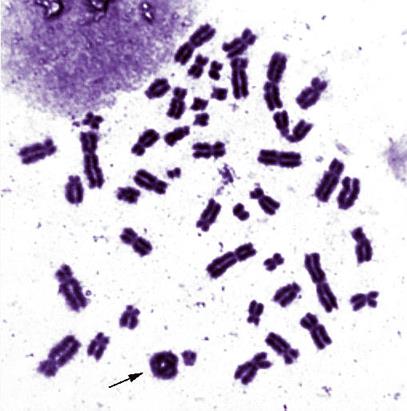
Рисунок V, 42. Кольцевая хромосома. Фотография Е.Г. Нероновой.
Хромосомы с двумя центромерами (дицентрические хромосомы) (Рисунок V, 43) и хромосомные фрагменты без центромеры (ацентрические фрагменты) (Рисунок V, 44) возникают при нарушении спаривания гомологичных хромосом в мейозе у гетерозигот по парацентрическим инверсиям. Обычно в ходе нескольких митотических делений ацентрические фрагменты теряются, а дицентрики формируют характерные «мосты» в анафазе и разрываются, образуя в интерфазе микроядра – хроматиновые тельца в цитоплазме. Подобного рода перестройки могут происходить и в соматических клетках под воздействием сильных мутагенов (например, радиации).
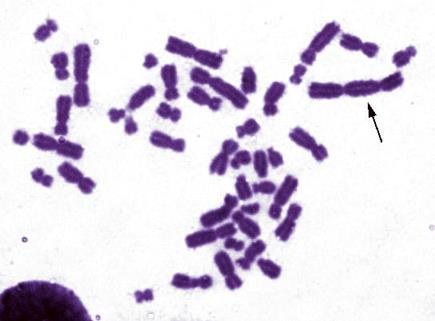
Рисунок V, 43. Дицентрическая хромосома. Фотография Е.Г. Нероновой.
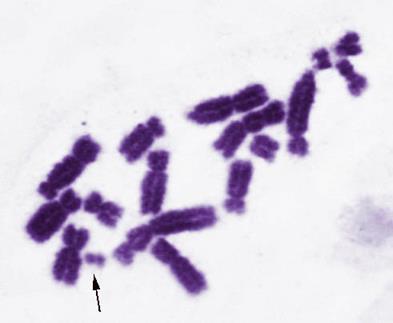
Рисунок V, 44. Ацентрический фрагмент.
Примеры:
46, ХХ, r (D) – женский кариотип, содержащий одну кольцевую хромосому из группы D.
46, Х, i (Xp) – женский кариотип, в котором одна Х-хромосома нормальная, а другая – изохромосома, состоящая из короткого плеча.
Наиболее известным случаем хромосомных аберраций человека является синдром кошачьего крика (или синдром Лежена) – HSA5 del (5p-). Обычно делетировано от трети до половины короткого плеча хромосомы 5, реже встречается полная делеция 5p (Рисунок V, 45). Синдром встречается с частотой 1 на 45000. Наследуется по аутосомно-доминантному типу. Отмечается низкая масса при рождении, мышечная гипотония, гипертелоризм глаз, изменение гортани, приводящее к характерному типу плача ребенка, напоминающему мяуканье кошки. Последний признак проходит к концу первого года жизни. У больных встречаются микроцефалия, врожденные пороки сердца, костно-мышечной системы и внутренних органов, деформация ушных раковин, эпикантус, антимонголоидный разрез глаз (Рисунок V, 46).
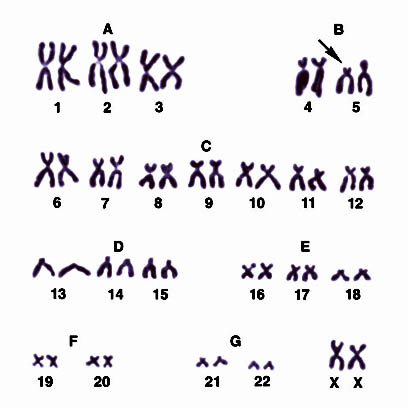
Рисунок V, 45. Хромосомный набор больной с синдромом кошачьего крика: групповая (от А до G) и индивидуальная идентификация хромосом (стрелкой указан дефект короткого плеча хромосомы 5-й пары). По материалам сайта http://medarticle23.moslek.ru/articles/45310.htm.
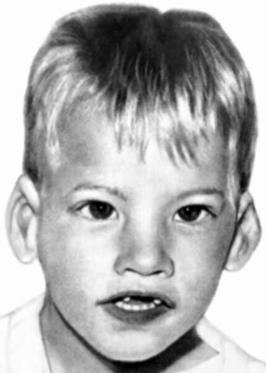
Рисунок V, 46. Ребенок с синдромом кошачьего крика. По материалам сайта http://medarticle23.moslek.ru/articles/34943.htm.
Синдром Вольфа-Хиршхорна (синдром 4p) возникает по причине дефишенси (терминальной делеции) короткого плеча хромосомы 4. Синдром встречается с частотой 1 на 96000 живых новорожденных. У большинства больных делетирован район 4p16.3, величина делеции – около 165 т.п.н. При меньшем размере делетированного участка проявляется менее выраженный фенотип. Использование рутинной окраски хромосом позволяет выявить эту аберрацию только в 60% случаев. Флуоресцентная гибридизация in situ дает возможность выявлять до 95% носителей. Для больных характерна микроцефалия, задержка внутриутробного развития, «рыбий» рот, краниофациальный дисморфизм, расщелину губы и неба, низкорасположенные деформированные ушные раковины, гипертелоризм (Рисунок V, 47). Из внутренних органов чаще всего поражаются почки (диплазия, кисты), сердце (атриальный или вентрикулярный септальные дефекты) и семенники (крипторхизм). Выживает не более 20% новорожденных с этим синдромом, продолжительность жизни – до 25 лет. У больных наблюдается грубая задержка умственного развития.

Рисунок V, 47. Ребенок с синдромом Вольфа-Хиршхорна. По материалам сайта http://en.wikipedia.orgwikiWolf-Hirschhorn_syndrome
В некоторых популяциях человека широко распространены перицентрические инверсии inv 9 (p11; q13) (Рисунок V, 48) и inv 10 (p11; q21) (Рисунок V, 49), не имеющие фенотипического проявления. Хотя некоторые авторы указывают на возможность снижения фертильности у их носителей, поскольку инверсии затрудняют коньюгацию гомологичных хромосом у гетерозигот и подавляют кроссинговер на своих участках.
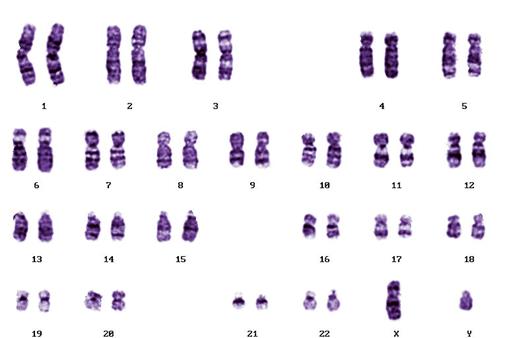
Рисунок V, 48. Перицентрическая инверсия HSA9. Фотография Е.Г. Нероновой.
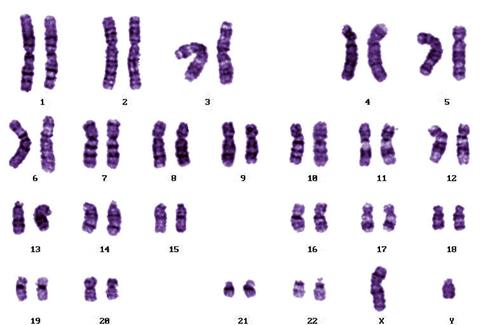
Рисунок V, 49. Перицентрическая инверсия HSA10. Фотография Е.Г. Нероновой.
В популяциях человека часто встречается полиморфизм (биологическое разнообразие) длины гетерохроматиновых районов, в том числе вторичных перетяжек. Такие изменения принято обозначать h+ - увеличение гетерохроматинового района (в том числе вторичных перетяжек) по сравнению с нормой и h- - уменьшение. Как правило, фенотипического эффекта такие полиморфные варианты не имеют.
Примеры:
46, 15 ph+ - увеличение длины вторичной перетяжки в коротком плече хромосомы 15;
46, 21ph- - уменьшение длины вторичной перетяжки в коротком плече хромосомы 21;
46, XY, Yqh+ - увеличение гетерохроматинового района Y-хромосомы.
Причиной хронического миелобластного лейкоза (ХМЛ) является соматическая мутация - слияние части гена тирозинкиназы ABL1 9-й хромосомы с геном BCR 22-й хромосомы с образованием химерного белка (Рисунок V, 50) . Филадельфийская хромосома, выявляемая у всех страдающих ХМЛ, - результат реципрокной транслокации t (9; 22), (q34; q11). Название «филадельфийская» этой аберрантной хромосоме дано потому, что впервые ее обнаружили сотрудники Пенсильванского университета в Филадельфии. ХМЛ - миелопролиферативное заболевание, при котором в норме находящиеся в фазе G0 гранулоциты (нейтрофилы, базофилы и эозинофилы) начинают активно делиться под влиянием химерного белка BCR/ABL1. В хронической фазе заболевания больные обычно чувствуют недомогание и переполнение живота. Акселеративная фаза заболевания может привести к бластному кризу, который протекает подобно острому лейкозу с быстрой прогрессией и небольшой выживаемостью.
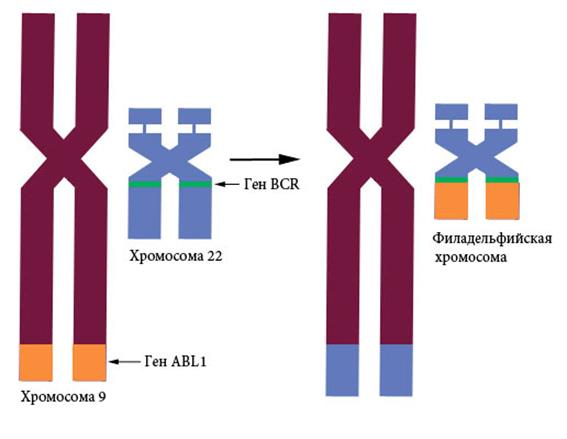
Рисунок V , 50. Филадельфийская хромосома.
Синдром Дауна иногда имеет транслокационную природу. Значительная часть хромосомы 21 может быть перемещена на другие хромосомы (чаще на 15, реже на 14, ещё реже на 21, 22 и Y-хромосому). В таких случаях при нормальном числе хромосом функционально будет присутствовать анеуплоидия по хромосоме 21.
На хромосоме X с частотой 1 на 1000 – 1 на 2000 новорожденных мальчиков в районе q27-28 наблюдается вторичная перетяжка – так называемый фрагильный сайт. Это синдром Мартина-Белл или синдром ломкой X -хромосомы. Молекулярный механизм заключается в экспансии тринуклеотидных ЦГГ (цитозин-гуанин-гуанин) повторов. В норме в районе Xq27.3 должно быть от 6 до 54 таких повторов, предмутационное состояние – от 55 до 200 таких повторов, этом случае у матерей с предмутационным состоянием возможно увеличение числа повторов в мейозе из-за неравного кроссинговера, и их потомки могут получить мутантную (с числом повторов более 200) X-хромосому. Наиболее выражено появление синдрома в гемизиготе, то есть у мальчиков с мутантной по фрагильному сайту X-хромосомой. Такие мальчики рождаются с весом 3,5 – 4 кг и макроорхизмом. Часто наблюдаются увеличенные размеры головы, длинное лицо с увеличенным подбородком, низкое расположение ушных раковин, повышенная подвижность суставов (Рисунок V, 51). Главные симптоматические признаки – умственная отсталость и своеобразные нарушения речи – эхолалия (неосмысленное повторение чужих слов) и персеверация (бормочущая речь). Иногда отмечается ранний детский аутизм.
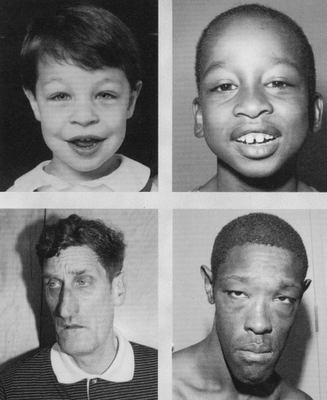
Рисунок V , 52. Синдром Мартина-Белл. По материалам сайта http://blog.ahfr.org/2008/05/fragile-x-syndrome.html
Следует отметить, что для всех хромосомных аберраций характерны общие фенотипические проявления: низкий вес при рождении, задержка развития, низкий рост, микроцефалия, микрогнатия, нарушения остеогенеза, аномальное расположение глаз.
Контрольные вопросы и задания к главе V
1. Прочитайте кариологический диагноз:
а) 46, XX, t (1; 22), (q24; q12)
б) 46, XX, inv 7 (p11; p13)
в) 47, XY, +22, r (5)
г) 48, XXYY
д) 46, XX, inv 4 (q11; q21)
е) 45, X, inv X (p11; q13)
ж) 46, XY, i (4q)
з) 48, XX, +21, +16p+
и) 45, X, 22ph+
2. Поставьте кариологический диагноз на основе фотографий митотических хромосом на рисунке V, 52.
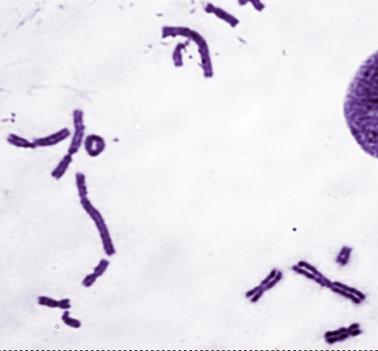
А.
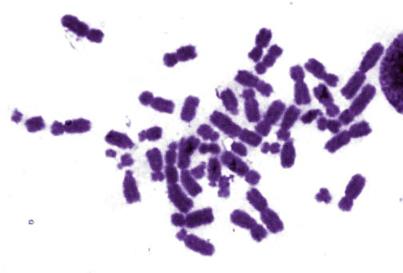
Б.

В.
Г.
Д.
Е.

Ж.
Рисунок V , 52. Фотографии фрагментов метафазных пластинок для задачи 2 к главе V. Фотографии Е.Г. Нероновой.
Дополнительная литература к главе V
Фогель Ф., Мотульски А. Генетика человека. Т. 1 // М: Мир. 1989. 308 С.
Дата добавления: 2021-07-19; просмотров: 709; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
