Цепной механизм самовоспламенения реакционных смесей
Виды горения
Диффузионное горение Характеризуется раздельным подачей в зону горения горючего и окислителя. Перемешивание комонентов происходит в зоне горения. Пример: горение водорода и кислорода в ракетном двигателе, горение газа в бытовой газовой плите.
Горение предварительно смешанной среды (гомогенное горение) Как следует из названия, горение происходит в смеси, в которой одновременно присутствуют горючее и окислитель. Пример: горение в цилиндре двигателя внутреннего сгорания бензиново-воздушной смеси после инициализации процесса свечой зажигания.
Беспламенное горение В отличие от обычного горения , когда наблюдаются зоны окислительного пламени и восстановительного пламени, возможно создание условий для беспламенного горения . Примером может служить каталитическое окисление органических веществ на поверхности подходящего катализатора, например, окисление этанола на платиновой черни.
Тление Вид горения , при котором пламя не образуется, а зона горения медленно распространяется по материалу. Тление обычно наблюдается у пористых или волокнистых материалов с высоким содержанием воздуха или пропитанных окислителями. Тление в определённых условиях приводит к самовозгоранию материалов.
Автогенное горение Самоподдерживающиеся горение . Термин используется в технологиях сжигания отходов. Возможность автогенного (самоподдерживающегося) горения отходов определяется предельным содержанием балластирующих компонент: влаги и золы. На основе многолетних исследований шведский ученый Таннер предложил для определения границ автогенного горения использовать треугольник-схему с предельными значениями: горючих более 25%, влаги менее 50%, золы менее 60%.[1]
Горение и взрыв В определённых условиях скорость горения может меняться, при этом можно наблюдать процессы перехода горения во взрыв. При высоких скоростях горения генерируются звуковые волны, например при сжигании смеси водорода с кислородом можно наблюдать изменение частоты звука горения в зависимости от соотношения концентраций.
3. Горючие и окисляющие вещества.
Горючими называются вещества , способные самостоятельно гореть после изъятия источника загорания.
По степени горючести вещества делятся на: горючие (сгораемые), трудногорючие (трудносгораемые) и негорючие (несгораемые).
К горючим относятся такие вещества, которые при воспламенении посторонним источником продолжают гореть и после его удаления.
К трудногорючим относятся такие вещества, которые не способны распространять пламя и горят лишь в месте воздействия источника зажигания.
Негорючими являются вещества, не воспламеняющиеся даже при воздействии достаточно мощных источников зажигания (импульсов).
Горючие вещества могут быть в трех агрегатных состояниях: жидком, твердом и газообразном (возможно и 4-ое состояние вещества – плазма)
Большинство горючих веществ независимо от агрегатного состояния при нагревании образует газообразные продукты, которые при смешении с воздухом, содержащим определенное количество кислорода, образуют горючую среду. Горючая среда может образоваться при тонкодисперсном распылении твердых и жидких веществ. Из горючих газов и пыли образуются горючие смеси при любой температуре, в то время как твердые вещества и жидкости могут образовать горючие смеси только при определенных температурах.
При горении твердых материалов горючее вещество и воздух не перемешаны, имеют поверхность раздела, и горение протекает в так называемом диффузионном режиме, т.е. скорость реакции определяется скоростью подвода (отвода) продуктов реакции (лимитирующая стадия - диффузия).
Если молекулы кислорода хорошо перемешаны с горючим веществом – горение определяется кинетикой химической реакции (обмен электронами), а режим -кинетическим. Горение такой смеси может происходить в виде взрыва.
Вещества окисляющие (окисляющиеся) — вещества, поддерживающие горение, вызывающие воспламенение и / или способствующие воспламенению др. веществ в результате окислительно-восстановительной экзотермической реакции. (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
На основании степени их опасности окисляющие вещества отнесены к одной из следующих групп: а = окислители, сильно способствующие горению
b = окислители, способствующие горению
с = окислители, незначительно способствующие горению
Окислителем в процессе горения может быть кислород, а также хлор, бром и другие вещества.
В большинстве случаев при пожаре окисление горючих веществ происходит кислородом воздуха.
В воздухе содержится около 21% кислорода. Горение большинства веществ становится невозможным, когда содержание кислорода в воздухе понижается до 14-18%, и только некоторые горючие вещества (водород, этилен, ацетилен и др.) могут гореть при содержании кислорода в воздухе до 10% и менее. При дальнейшем уменьшении содержания кислорода горение большинства веществ прекращается.
4. Общее понятие о цепных реакциях и автокатализе.
К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция ).
Разветвленные цепные реакции характеризуются тем, что в каждом элементарном акте продолжения цепи происходит увеличение числа активных частиц (напр., окисление водорода кислородом). Это приводит к автокатализу и при критических условиях к самовоспламенению, или цепному взрыву.
В цепных реакциях выделяют три стадии: зарождение цепи, ее развитие и обрыв. Зарождение (иницирование) происходит под воздействием светового, радиационного, термического или другого воздействия.
Цепные реакции — химические и ядерные реакции, в которых появление активной частицы (свободного радикала или атома в химических, нейтрона в ядерных процессах) вызывает большое число (цепь) последовательных превращений неактивных молекул или ядер. Свободные радикалы или атомы в отличие от молекул обладают свободными ненасыщенными валентностями (непарным электроном), что приводит к их взаимодействию с исходными молекулами. При первом же столкновении свободного радикала (R°) с молекулой происходит разрыв одной из валентных связей последней, и, таким образом, в результате реакции образуется новая химическая связь и новый свободный радикал, который в свою очередь реагирует с другой молекулой — происходит цепная реакция
Автокатализ (от авто... и катализ), ускорение химической реакции одним из её продуктов
Катализ (от греч. katálysis — разрушение), изменение скорости химических реакций в присутствии веществ (катализаторов),вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Реакции с участием катализаторов называются каталитическими
Катализаторы, вещества, изменяющие скорость химических реакций посредством многократного промежуточного химического взаимодействия с участниками реакций и не входящие в состав конечных продуктов. Более 70% всех химических превращений веществ, а среди новых производств более 90% осуществляется с помощью К.
5. Деструкция веществ и энерговыделение при горении. Продукты горения.
Деструкция - разложение органических веществ и превращение их в неорганические с высвобождением энергии. лат.Destructio – разрушение
При горении веществ в воздухе происходит быстрая химическая реакция между горючим веществом и кислородом воздуха с интенсивным тепловыделением.
Образование пламени связано с газообразным состоянием веществ , поэтому горение жидких и твердых веществ предполагает их переход в газообразную фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении с испарением у поверхности. При горении почти всех твердых материалов образование веществ , способных улетучиваться с поверхности материала, и попадание в область пламени происходит путем химического разложения (пиролиза)
При полном горении продуктами сгорания являются двуокись углерода (CO2), вода (H2O), азот (N), сернистый ангидрид (SO2), фосфорный ангидрид. При неполном горении обычно образуются едкие, ядовитые горючие и взрывоопасные продукты: окись углерода, спирты, кислоты, альдегиды.
6. Температуры горения.
Тепло, выделяющееся при сгорании топлива, воспринимается продуктами сгорания, которые нагреваются до определенной температуры , называемой температурой горения . Различают калориметрическую, теоретическую и действительную температуры сгорания топлива.
В уравнение теплового баланса реального горения входят составляющие, величина которых зависит не только от теплофизических свойств топлива, но и от условий, при которых протекает горение . Например, от степени подогрева топлива и воздуха, потерь теплоты при горении , тепловосприятия в топке, коэффициента избытка воздуха.
Чтобы выявить потенциальные возможности топлива, вводят понятие горения без подогрева топлива и воздуха при идеальном адиабатическом процессе, т. е. горения с теоретическим количеством воздуха, без потерь теплоты и без теплообмена в топочной камере и с окружающей средой. Полученная в этих условиях температура продуктов сгорания называется теоретической.
Калориметрическая температура отражает влияние подогрева топлива и воздуха и коэффициента избытка расхода воздуха α на температуру адиабатического горения . Повышение температуры подогрева топлива и воздуха увеличивает приход теплоты в зону горения и повышает температуру горения , а увеличение коэффициента избытка воздуха α вызывает увеличение объема продуктов сгорания Vг, что понижает температуру горения . Поэтому в зависимости от влияния этих факторов калориметрическая температура может быть выше или ниже теоретической.
В реальных условиях не все тепло, выделяющееся при горении , идет на нагрев продуктов реакции, так как часть тепла передается экранной системе топочной камеры и некоторое количество тепла теряется в окружающую среду; кроме того, при высоких температурах происходит диссоциация части продуктов сгорания (СО2 и Н2О), сопровождающаяся поглощением тепла.
Отношение действительной температуры горения топлива к теоретической называется пирометрическим коэффициентом.
7. Ламинарный и турбулентный газодинамические режимы горения
Дозвуковое горение (дефлаграция) в отличие от взрыва и детонации протекает с низкими скоростями и не связано с образованием ударной волны. К дозвуковому горению относят нормальное ламинарное и турбулентное распространения пламени, к сверхзвуковому — детонацию.
Ламинарное пламя обладает вполне определённой скоростью перемещения относительно неподвижного газа, которая зависит от состава смеси, давления и температуры и определяется только химической кинетикой и молекулярной теплопроводностью. Эта нормальная скорость является физико-химической константой смеси.
Скорость распространения турбулентного пламени зависит от скорости потока, а также степени и масштаба турбулентности. Горение в потоке (факельный процесс) – это Г. струи при её истечении из трубы (сопла) в открытое пространство или камеру — очень распространённый в технике вид Г. Различают Г. при истечении заранее перемешанной смеси и Г. при раздельном истечении горючего и окислителя, когда процесс определяется перемешиванием (диффузией) двух потоков.
8. Гомогенное и гетерогенное горение.
Горениемназывается сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и сопровождающийся выделением большого количества тепла и света. (Обычно в качестве окислителя участвует кислород воздуха, которого содержится около 21%).
Для возникновения и развития процесса горения необходимы: горючее вещество, окислитель и источник воспламенения, инициирующий реакцию.
Горючее вещество и окислитель должны находиться в определенных соотношениях друг с другом.
Горение , как правило, происходит в газовой фазе. Поэтому горючие вещества, находящиеся в конденсированном состоянии (жидкие, твердые материалы), для возникновения и поддержания горения должны подвергаться газификации (испарению, разложению), в результате которой образуются горючие пары и газы в количестве, достаточном для горения .
В зависимости от агрегатного состояния горючих веществ горение может быть гомогенным и гетерогенным .
Гомогенное горение : компоненты горючей смеси находятся в газообразном состоянии. Причем, если компоненты перемешаны, то горение называют кинетическим. Если не перемешаны – диффузионное горение.
Гетерогенное горение : характеризуется наличием раздела фаз в горючей смеси (горение жидких и твердых горючих веществ в среде газообразного окислителя).
Горение различается также по скорости распространения пламени и в зависимости от этого фактора оно может быть:
- дефлаграционным (скорость пламени в пределах нескольких метров с секунду);
- взрывным (скорость пламени до сотен метров в секунду);
- детонационным(скорость пламени порядка тысяч метров в секунду).
Кроме того различают: ламинарное горение, характеризуемое послойным распространением фронта пламени по горючей смеси; турбулентное , характеризуемое перемешиванием слоев потока и повышенной скоростью выгорания.
Равномерное распространение горения устойчиво лишь в том случае, если оно не сопровождается повышением давления. Когда горение происходит в замкнутом пространстве, или выход газообразных продуктов затруднителен, то повышение температуры приводит к интенсивному расширению газовых объемов и взрыву.
Под взрывом понимают быстрое превращение веществ, сопровождающееся выделением энергии и образованием сжатых газов, способных производить работу.
Пожаром называется неконтролируемое горение вне специального очага, наносящее материальный ущерб и представляющее опасность для людей.
9. Кинетический и диффузионный режимы горения.(2)
Горючие системы подразделяются на однородные и неоднородные. Однородными являются системы, в которых горючее вещество и воздух равномерно перемешаны друг с другом (смеси горючих газов, паров с воздухом). Горение таких систем называют горением кинетическим. Скорость его определяется скоростью химической реакции, значительной при высокой температуре. При определенных условиях такое горение может носить характер взрыва или детонации. Неоднородными являются системы, в которых горючее вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые горючие материалы и не распыленные жидкости). В процессе горения неоднородных горючих систем кислород воздуха проникает (диффундирует) сквозь продукты горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным горением, так как его скорость определяется главным образом, сравнительно медленно протекающим процессом-диффузией.
10. Влажность, летучие продукты пиролиза и межфазовые переходы
Пиролиз (от греч. руr-огонь и lysis-разложение, распад)– разложение или др. превращения хим. соединений при нагревании.
Образование пламени связано с газообразным состоянием вещества, поэтому горение жидких и твердых веществ, сопровождающееся возникновением пламени, предполагает их предварительный переход в газообразную фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении с испарением у поверхности, в то время как при горении почти всех твердых веществ образование продуктов, способных улетучиваться с поверхности материала и попадание в область пламени, происходит путем химического разложения или пиролиза.
Для протекания процесса горения необходимо горючее вещество, кислород (воздух) и источник воспламенения. Горючее вещество и кислород составляют горючую систему. Источник воспламенения вызывает в ней реакцию окисления. При установившемся горении источником воспламенения служит теплота зоны реакции.
Горючие системы могут быть однородными (однофазными, гомогенными) и неоднородными (многофазными, гетерогенными, гетерофазными). К гомогенным относятся газообразные системы, в которых горючее вещество и окислитель перемешаны друг с другом, например, смеси горючих газов с воздухом. К неоднородным относятся системы, в которых горючее вещество и окислитель находятся в разных фазах, отделены друг от друга поверхностью раздела, например твердые горючие материалы и жидкости, находящиеся в соприкосновении с воздухом, струи горючих газов, поступающие в воздух.
При горении гетерогенных горючих систем кислород, для того чтобы вступить в реакцию с горючим веществом, должен продиффундировать через область пространства, занятую смесью воздуха и продуктов горения.
При высоких температурах наблюдается диффузионное горение, при низких — кинетическое
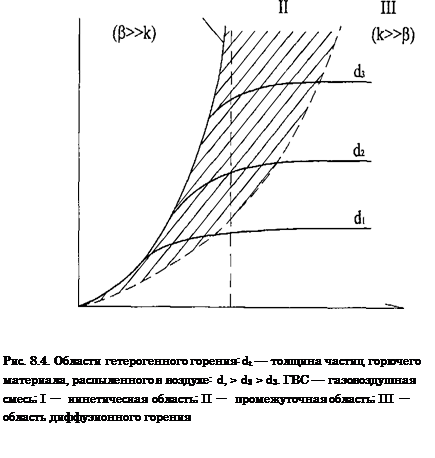 Горение всех видов газов, жидкостей и твердых веществ на пожарах (за исключением некоторых взрывчатых веществ и пиротехнических изделий) является диффузионным. Так как наблюдаемая скорость химической реакции в диффузионной области определяется скоростью диффузии кислорода в зону реакции, то все реакции горения в этой области имеют одинаковую скорость, не зависящую от природы горючего. Температурная зависимость скорости реакции в этой области сравнительно невелика и определяется изменением физических констант (коэффициента диффузии, вязкости и т.д.) от температуры.
Горение всех видов газов, жидкостей и твердых веществ на пожарах (за исключением некоторых взрывчатых веществ и пиротехнических изделий) является диффузионным. Так как наблюдаемая скорость химической реакции в диффузионной области определяется скоростью диффузии кислорода в зону реакции, то все реакции горения в этой области имеют одинаковую скорость, не зависящую от природы горючего. Температурная зависимость скорости реакции в этой области сравнительно невелика и определяется изменением физических констант (коэффициента диффузии, вязкости и т.д.) от температуры.
При горении гомогенных горючих систем, в которых окислитель и горючее вещество находятся в одной фазе, диффузионные явления обычно роли не играют.
Горение, зависящее только от скорости химической реакции, называется кинетическим. Скорость кинетического горения смесей значительно превышает скорость диффузионного горения горючих веществ, находящихся в них. Горение таких смесей в замкнутом объеме представляет взрыв. На практике кинетическое горение наблюдается только в начальной фазе пожара. Так, пожар ЛВЖ в резервуарах часто возникает в результате взрыва образовавшейся в них смеси паров жидкости с воздухом. При взрыве смеси крыша резервуара сбрасывается и горение паров жидкости происходит в диффузионной области.
11. Калориметрическая (адиабатическая) температура горения.
Реальная температура горения.
Выделяющаяся в зоне горения теплота воспринимается продуктами сгорания, вследствие чего они нагреваются до высокой температуры. Различают калориметрическую, теоретическую и действительную температуры горения.
Действительной температурой горения называется температура реально устанавливающаяся в условиях пожара.
Под калориметрической температурой понимается температура, которую приобретают продукты полного сгорания, когда вся теплота расходуется на их нагревание.
При вычислении теоретической температуры пренебрегают потерями теплоты в окружающую среду, но учитывают расход теплоты на диссоциацию продуктов реакции (что происходит при температурах выше 1973 К).
Калориметрическую температуругорения вычисляют для следующих постоянных условий:
–воздух и горючее вещество находятся при нормальных условиях (273 К);
–коэффициент избытка воздуха равен единице;
–вещество полностью сгорает (недожог отсутствует);
– потери теплоты отсутствуют (процесс адиабатный).
Цепной механизм самовоспламенения реакционных смесей
Процессы самовоспламенения могут иметь тепловой, цепной и комбинированный цепочечно-тепловой характер. Формулировка основных положений теории цепных реакций дана в трудах Н. Н. Семенова и его школы. Сущность этой теории заключается в следующем. Инициированная каким-либо образом химическая реакция приводит к образованию активных центров. В свою очередь, эти центры вызывают химические превращения, при которых вновь создаются активные центры, и в конечном итоге возникает цепная реакция.
Начавшийся процесс химических превращений будет продолжаться до тех пор, пока на одном из звеньев начальный центр не вступит в реакцию обрыва. Обрыв цепи может происходить либо в объеме реагирующей смеси при взаимодействии начальных центров реакции между собой или с какими-либо примесями, либо на поверхности стенок реакционного сосуда.
Процессом зарождения цепи всегда является эндотермическая реакция. Поглощение энергии необходимо для разрыва внутримолекулярных связей. Энергия активации, необходимая для элементарных актов продолжения цепи, обеспечивается тепловым эффектом одного из экзотермических процессов продолжения цепи.
Реакции, протекающих по механизму прямых цепей, не могут привести сами по себе к возникновению самовоспламенения поскольку длина прямой цепи всегда конечна и скорость образования начальных центров цепей при начавшейся реакции убывает (вследствие расходования компонентов). Самовоспламенение является следствием протекания разветвленных цепных реакций, отличающихся тем, что в них наряду с актами продолжения цепи возникают и такие реакции, в которых взамен одного прореагировавшего активного центра возникают по крайней мере два новых.
Дата добавления: 2021-07-19; просмотров: 291; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
