Применение уравнения состояния идеального газа к исследованиям газовых смесей.
В практике работы тепловых машин и аппаратов чаще всего приходится иметь дело не с чистыми газами, а их смесью. Например, продукты сгорания топлив представляют из себя смесь воздуха, углекислого газа и оксида углерода. Большинство смесей газов с достаточной точностью подчиняются уравнению Клайперона. Однако для его использовании необходимо определить молекулярную массу смеси газов и ее газовую постоянную.
Исходным принципом для расчетов термодинамических процессов с участием смесей газов служит закон Дальтона: в газовой смеси каждый компонент проявляет себя так, как если бы другие компоненты отсутствовали, т.е. каждый газ занимает весь предоставленный ему объем и находится под своим парциальным давлением.
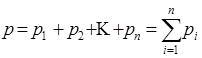 (1.8)
(1.8)
При равномерном перемешивании компонентов газовой смеси она представляет собой однородную среду, которая характеризуется своей молекулярной массой  . Для ее определения необходимо задать количественный состав смеси: по массе, объему или числу молей компонентов.
. Для ее определения необходимо задать количественный состав смеси: по массе, объему или числу молей компонентов.
1. Состав газовой смеси задан числом молей ее компонентов.
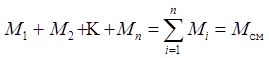 ,
,
где Мi - число молей iого компонента смеси;  - общее число молей в смеси. Для данного случая условие равенства масс компонентов смеси запишется в виде:
- общее число молей в смеси. Для данного случая условие равенства масс компонентов смеси запишется в виде: 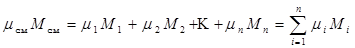 . Исходя из этого соотношения молекулярную массу газовой смеси можно определить как:
. Исходя из этого соотношения молекулярную массу газовой смеси можно определить как:
|
|
|
 . (1.9)
. (1.9)
2. Состав смеси задан объемами компонентов, приведенных к общему давлению.
 ,
,
где 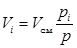 - частный объем iого компонента газовой смеси, приведенный к общему давлению смеси “p” (данное выражение получено на основе закона Бойля-Мариотта); pi - парциальное давление iого компонента смеси;
- частный объем iого компонента газовой смеси, приведенный к общему давлению смеси “p” (данное выражение получено на основе закона Бойля-Мариотта); pi - парциальное давление iого компонента смеси;  - полный объем смеси.
- полный объем смеси.
По известным частным объемам компонентов смеси, приведенных к общему давлению можно определить их объемные доли “r” как: r1=V1 / Vсм , r2=V2 / Vсм , .... rn=Vn / Vсм . При этом
 . (1.10)
. (1.10)
Между объемными долями компонентов и их числом молей в газовой смеси существует связь:
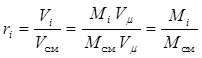 . (1.11)
. (1.11)
Заменив в уравнении (1.9) отношение количества молей iтых компонентов к количеству молей смеси на объемные доли, окончательно получим:
 , (1.12)
, (1.12)
3. Состав смеси задан массами компонентов:
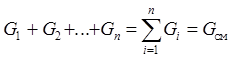 ,
,
где Gi - масса iог компонента газовой смеси; Gсм - полная масса смеси.
|
|
|
По известным массам компонентов смеси можно определить их массовые доли “g”: g1=G1 / Gсм , g2=G2 / Gсм , .... gn=Gn / Gсм . Между массовыми и объемными долями компонентов смеси существует связь:
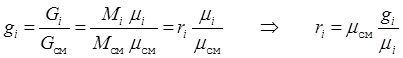 .
.
Так как в соответствии с уравнением (1.10) сумма объемных компонентов смеси всегда равна единице, окончательно можно записать:
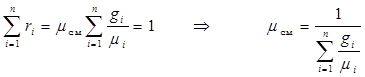 . (1.13)
. (1.13)
Зная молекулярную массу газовой смеси, с помощью соотношения 1.7 можно определить ее газовую постоянную и далее для определения параметров состояния газовой смеси воспользоваться одним из видов уравнения состояния идеального газа.
Еще одним важным вопросом, возникающем при исследовании термодинамических процессов с участием газовых смесей, является определение парциальных давлений компонентов смеси (в реальных условиях с помощью приборов возможно замерить только полное давление смеси).
Значения парциальных давлений компонентов газовой смеси определяются расчетным путем в зависимости от того, каким способа задания количественного состава смеси. Если смесь задана по объему компонентов, то
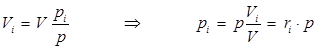 . (1.14)
. (1.14)
Если смесь задана числом молей компонентов, то
|
|
|
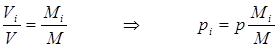 , (1.15)
, (1.15)
а если смесь задана по массе компонентов, то в соответствии с соотношениями между объемными и массовыми долями компонентов
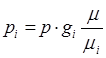 . (1.16)
. (1.16)
Теплоемкость газов.
Теплоемкость это физическое свойство тела, измеряемое количеством теплоты, затрачиваемой при нагреве единицы количества вещества на один градус Кельвина.
В зависимости от единиц измерения количества вещества для газов различают три вида теплоемкости:
* C [ кДж/кг × К ] - массовая теплоемкость;
* С‘ [ кДж/м3 × К ] - объемная теплоемкость ( отнесена к 1 м3 газа при
при нормальных условиях);
* m С [ кДж/кмоль × К ] - мольная теплоемкость.
Теплоемкость газов зависит от их физических свойств и в первую очередь от атомности (с повышением количества атомов в молекуле газа теплоемкость возрастает). Кроме того, теплоемкость зависит от параметров состояния газа, главным образом от температуры (с ростом температуры она возрастает), а также от характера протекающего процесса (нагревается или охлаждается газ, процесс протекает при p=сonst или при v=сonst).
|
|
|
В тех случаях, когда теплоемкость относится к строго определенному процессу она является свойством вещества. С этой точки зрения в термодинамике в качестве основных приняты теплоемкости процессов, протекающих при постоянном объеме (изохорные) и при постоянном давлении (изобарные) (табл.1.1).
Таблица 1.1
| Вид | Размерность | Тип процесса | |
| теплоемкости | изохорная | изобарная | |
| Массовые | кДж/кг×К | Cv | Сp |
| Объемные | кДж/м3×К | Cv’ | Cp’ |
| Мольные | кДж/кмоль×К | m Cv | m Cp |
Значения изобарных и изохорных теплоемкостей газов приводится в справочных таблицах. В условиях идеального газа, между изобарными и изохорными теплоемкостями установлены следующие зависимости:
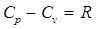 , [ кДж/кг×К]; (1.17)
, [ кДж/кг×К]; (1.17)
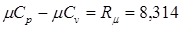 , [кДж/кмоль×К]; (1.18)
, [кДж/кмоль×К]; (1.18)
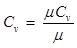
 ,
, 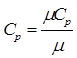
 , [ кДж/кг×К]; (1.19)
, [ кДж/кг×К]; (1.19)
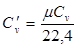
 ,
, 
 , [ кДж/м3×К]. (1.20)
, [ кДж/м3×К]. (1.20)
Как отмечалось, теплоемкость является функцией от температуры тела. Сообщение рабочему телу теплоты в ходе термодинамического процесса вызывает изменение его состояния и в общем случае сопровождается изменением его температуры, что связано с увеличением внутренних колебаний его молекул. Поэтому, каждой температуре будет соответствовать свое строго определенное значение теплоемкости.
Отношение элементарного количества теплоты (dq ), полученного телом при бесконечно малом изменении его состояния к изменению температуры ( dt ) называется истинной удельной теплоемкостью данного процесса.
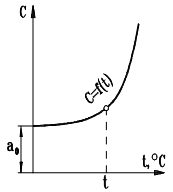
|
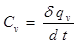 ,
, 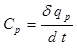 (1.21)
(1.21)
Зависимость истинной теплоемкости от температуры носит нелинейный характер (рис. 1.6) и представляется полиномом вида:
 ,
,
где 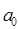 ,
, 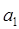 ,
, 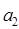 - постоянные коэффициенты, различные для различных газов;
- постоянные коэффициенты, различные для различных газов; 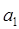 и
и 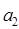 характеризуют крутизну кривой, а
характеризуют крутизну кривой, а 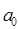 - теплоемкость при нормальных условиях.
- теплоемкость при нормальных условиях.
Значения истинных теплоемкостей рабочих тел определяются экспериментально и приводятся в справочных таблицах.
Исходя из определения истинной теплоемкости, количество теплоты, сообщаемое газу при бесконечно малом изменении его состояния определится как:  .
.
В практике инженерных расчетов чаще всего требуется определить количество теплоты, которое сообщается термодинамической системе в конечно процессе. При этом пользоваться понятием истинной теплоемкости неудобно, т.к. постоянно приходится интегрировать по всему диапазону интервала температур, в котором нагревается или охлаждается газ:
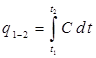 . (1.22)
. (1.22)
Поэтому, для удобства проведения технических расчетов вводится условное понятие средней теплоемкости газа “ 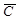 “.
“.
Средней теплоемкостью данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, подведенного в данном процессе к конечной разности температур.
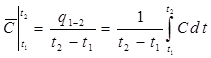 (1.23)
(1.23)
Уравнение 1.23 устанавливает связь между средней и истинной теплоемкостями рабочего тела В соответствии с ним количество тепла, сообщаемого в конечном термодинамическом процессе, определится как:
 . (1.24)
. (1.24)
Определять большое количество средних теплоемкостей для различных интервалов температур достаточно затруднительно, поэтому в справочных таблицах приводятся значения средних изобарных и изохорных теплоемкостей для интервалов температур от 0 до t 0C: 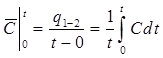 .
.
Зная среднюю теплоемкость для интервала температур от 0 до t oC, можно определить среднюю теплоемкость для любого процесса и количество теплоты, сообщаемое в нем:

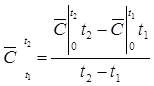 , (1.25)
, (1.25)
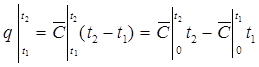 . (1.26)
. (1.26)
Для газов, при t < 200 °C рост количества подводимого тепла с ростом температуры незначителен. Поэтому для данного интервала температур теплоемкость газа можно считать постоянной и равной теплоемкости при 0 °С.
Для газовых смесей (продукты сгорания топлив и др.) истинная и средняя теплоемкость может быть определена в зависимости от состава смеси по соответствующим теплоемкостям компонентов:
1.) состав смеси задан по массе:
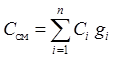 [кДж/(кг×К)]; (1.27(а))
[кДж/(кг×К)]; (1.27(а))
2.) состав смеси задан по объему:
 [кДж/(м3×К)]; (1.27(б))
[кДж/(м3×К)]; (1.27(б))
3.) состав смеси задан числом молей или по объему:
 [кДж/(кмоль×К)]. (1.27(в))
[кДж/(кмоль×К)]. (1.27(в))
Дата добавления: 2021-07-19; просмотров: 59; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
