Уравнение состояния однородного вещества и его частный случай применительно к идеальному газу.
В качестве основных параметров состояния рабочего тела приняты три: абсолютное давление “р”, абсолютная температура “Т” и удельный объем “v”. Однако из многочисленных физических опытов известно, что любое однородное вещество имеет лишь два независимых параметра состояния, всякий третий параметр обязательно зависит от первых двух. Поэтому при любых изменениях системы параметры р, v, Т всегда взаимосвязанны, и уравнение состояния однородного вещества в общем виде можно записать как:
F ( p , v , T ) = 0. (1.1)
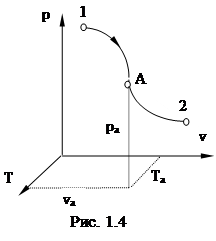
В соответствии с данным уравнением любое равновесное состояние однородного вещества, а также любой равновесный процесс можно изобразить в 3х осной системе координат p-v-T (рис.1.4). При этом равновесные состояния будут изображаться точками, а процессы - линиями.
|
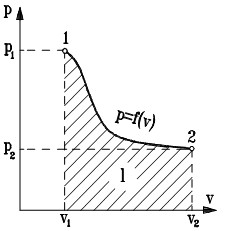
Однако практическое использование трехосных систем координат связано со значительными трудностями. Поэтому, учитывая что один из параметров состояния всегда зависит от двух других, в практике широкое распространение получили двухосные координаты: Ta=f(pa;va); pa= j (va:Ta); va= y (pa;Ta). При этом наиболее часто используется система “p - v” координат (рис. 1.5).
|
Особенностью р-v диаграммы является то, что помимо состояния т.д.с., изображаемого точками, и процессов, изображаемых линиями, площадь, расположенная под кривой процесса, изображает в некотором масштабе его работу (доказательство этого факта приведено в разделе, посвященном первому закону термодинамики).
|
|
|
Общий вид уравнения состояния любого однородного вещества можно записать и в дифференциальной форме. Если предположить, что v= y (p,T), то, учитывая что величина dv является полным дифференциалом, для элементарного термодинамического процесса можно записать:
 . (1.2)
. (1.2)
Для условия v=сonst , например при нагревании газа в баллоне, dv=0 и уравнение (1.2) перепишется в виде:
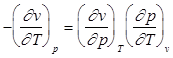 Þ
Þ 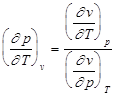 . (1.3)
. (1.3)
Частные производные, входящие в уравнение (1.3) называются термическими коэффициентами:
( ¶ p / ¶ T)v - термическая упругость вещества;
( ¶ v / ¶ T)p - термическая расширяемость вещества;
( ¶ v / ¶ p)T - термическая сжимаемость вещества.
Исходя из того, что рабочими телами тепловых машин являются газы и пары ( пары рассматриваются как газы, находящиеся близко к состоянию сжижения), можно сделать вывод, что для них будут справедливы общефизические газовые законы:
· закон Бойля-Мариотта - при T=сonst P × V=сonst (при постоянной температуре произведение давления на объем, занимаемый газом, есть величина постоянная);
|
|
|
· закон Гей-Люссака - при Т=сonst ( ¶ u / ¶ v)T = 0 и ( ¶ u / ¶ p)T = 0 ( при постоянной температуре внутренняя энергия некоторого количества газа от объема и давления не зависит).
Однако, реальные газы подчиняются этим законам лишь приблизительно, с большей или меньшей точностью, что связано с наличием в них межмолекулярного взаимодействия. Особенно это заметно у паров. Поэтому в целях удобства проведения термодинамических исследований вводится понятие воображаемого идеального газа.
Идеальный газ - это газ, у которого отсутствуют межмолекулярные взаимодействия и который в точности подчиняется всем газовым законам.
Необходимо отметить, что реальные газы O2, H2, N2, CO, CO2, H2O, находящиеся в состоянии далеком от сжижения, с достаточной степенью точности можно рассматривать как идеальный газ. Пары же жидкостей H2O, NH3 и других, находящихся близко к состоянию сжижения, по своим свойствам существенно отличаются от идеального газа и должны рассматриваться как реальные газы.
Согласно молеулярно-кинетической теории газов абсолютное давление газа числено равно 2/3 средней кинетической энергии поступательного движения молекул, заключенных в единице объема:
|
|
|
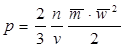 , (1.4)
, (1.4)
где p - давление; v - удельный объем; n - количество молекул в рассматриваемом объеме; 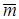 - масса одной молекулы;
- масса одной молекулы;  - средняя скорость молекулы;
- средняя скорость молекулы; 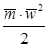 - средняя кинетическая энергия молекулы.
- средняя кинетическая энергия молекулы.
Так, как величина абсолютной температуры пропорциональна средней кинетической энергии молекул газа, то можно записать, что 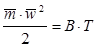 , где “B” - коэффициент пропорциональности. В соответствии с этим уравнение 1.4 перепишется в виде:
, где “B” - коэффициент пропорциональности. В соответствии с этим уравнение 1.4 перепишется в виде:
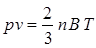 . (1.4(а))
. (1.4(а))
Уравнение 1.4(а) можно записать для двух состояний газа, находящегося под поршнем (рис. 1.3):
 ,
,
 .
.
Так как n=сonst и В=сonst следовательно и  . Константу, входящую в данное выражение называют газовой постоянной и обозначают “R”. Таким образом, уравнение состояния идеального газа, применительно к 1 кг его, запишется в виде:
. Константу, входящую в данное выражение называют газовой постоянной и обозначают “R”. Таким образом, уравнение состояния идеального газа, применительно к 1 кг его, запишется в виде:
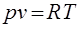 , (1.5)
, (1.5)
где р - давление [Па]; v - удельный объем [м3/кг]; T - температура [К]; R -газовая постоянная [Дж/кг×К].
С учетом того, что v = V / G уравнение (1.5) можно записать и для любой массы рабочего тела в виде:
|
|
|
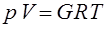 , (1.5(а))
, (1.5(а))
где V -полный объем занимаемый газом [м3]; G -масса газа [кг].
Уравнения состояния идеального газа (1.5 и 1.5(а)) носят название уравнение “Клайперона”. Мы получили его на основе молекулярно кинетической теории газов, хотя аналогично оно могло быть получено и при одновременном рассмотрении законов Бойля-Мариотта и Гей-Люссака.
Газовая постоянная R, входящая в уравнения (1.5 и 1.5(а)),представляет собой физическую константу, принимающую для каждого газа свое значение, зависящую от природы газа и независящую от его состояния ( для воздуха R=287 Дж/кг×К, для О2 R=260 Дж/кг×К ).
Численно газовая постоянная ”R” равна работе расширения 1 килограмма газа при его нагреве на 1 Кельвин при p=сonst.
Еще один вид уравнения состояния идеального газа можно получить, если в качестве единицы количества вещества принять киломоль - количество вещества по массе в килограммах, численно равное молекулярной массе данного вещества “m“ (например: O2 ® m = 32 Þ 1 кмоль = 32 кг; Н2 ® m = 1 Þ 1 кмоль = 2 кг).
Согласно закона Авагадро для всех газов при равных температурах и давлениях объем одного киломоля одинаков: V m = m × v = idem. Так, например, при нормальных условиях (po=101300 Па и to=0 °C) для любого газа V m = m × vo=22,4 м3/кмоль ( v0= 22.4 / m , r 0 = m / 22.4 ).
Заменим в уравнении (1.5а) G на m и V на V m и получим уравнение состояния идеального газа применительно к одному киломолю вещества, называемое уравнением “Менделеева-Клайперона”:
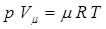 , (1.6)
, (1.6)
где m × R=R m =8314 [Дж/кмоль×К] - универсальная газовая постоянная, физическая константа, неизменная для всех газов.
 . (1.6(а))
. (1.6(а))
Знание универсальной газовой постоянной позволяет определять газовые постоянные любого газа:
 [Дж/кг×К] (1.7)
[Дж/кг×К] (1.7)
В технической практике уравнения 1.5, 1.5(а), 1.6(а) широко применяются для исследований термодинамических процессов в большой группе реальных газов в достаточно широком диапазоне температур и давлений, так как возникающая при их использовании погрешность оказывается незначительной. Более того, данные уравнения могут быть использованы и для исследований газовых смесей.
Дата добавления: 2021-07-19; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!